Το κύριο χαρακτηριστικό των αντιδράσεων οξειδοαναγωγής είναι ότι ταυτόχρονα ένα χημικό είδος χάνει ηλεκτρόνια (με την οξείδωση) και ένα άλλο αποκτά ηλεκτρόνια (με την αναγωγή).
Ωστόσο, σε ορισμένες αντιδράσεις είναι δυνατό να παρατηρηθεί ότι δεν υπάρχει μόνο οξείδωση και/ή αναγωγή. Παρακάτω είναι ένα παράδειγμα:
SnS + HCl + HNO3 → SnCl4 + S + ΟΧΙ + Η2Ο
Υπολογίζοντας τους αριθμούς οξείδωσης (Nox) όλων των ατόμων σε αυτή την αντίδραση, όπως περιγράφεται στο κείμενο «Προσδιορισμός του Αριθμού Οξείδωσης (Nox)», έχουμε:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + ΟΧΙ + Η2Ο
Ας ελέγξουμε τώρα ποιεςΟι ουσίες υπέστησαν διακυμάνσεις στο Nox τους και, κατά συνέπεια, οι οποίες οξειδώθηκαν και μείωσαν:
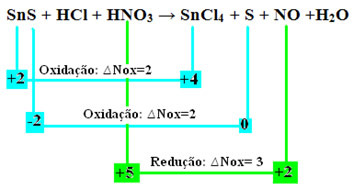
Σημειώστε ότι έχουν συμβεί δύο οξειδώσεις. Λοιπόν, σε αυτή την περίπτωση, πώς να εξισορροπηθεί η χημική εξίσωση;
Ένα σημαντικό πράγμα που πρέπει να έχετε κατά νου και που ισχύει για όλες τις αντιδράσεις οξειδοαναγωγής είναι ότι ο αριθμός των ηλεκτρονίων που δίνονται πρέπει πάντα να είναι ίσος με τον αριθμό των ηλεκτρονίων που λαμβάνονται.
Επομένως, για να εξισορροπήσετε αυτό το είδος αντίδρασης, ακολουθήστε τους ίδιους κανόνες που ορίζονται στο κείμενο "Εξισορρόπηση οξειδοαναγωγής», ωστόσο, με μία μόνο αλλαγή: ο προσδιορισμός της παραλλαγής Nox (ΔNox) του είδους που δημιούργησε τις δύο οξειδώσεις (SnS) θα είναι το άθροισμα των δύο ΔNox, που θα μας δώσει τη συνολική τιμή των χαμένων ηλεκτρονίων:
- SnS: ∆Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Σύνολο NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Έτσι, μπορούμε να προχωρήσουμε στα παρακάτω βήματα για την εξισορρόπηση:
Μη σταματάς τώρα… Υπάρχουν και άλλα μετά τη διαφήμιση ;)
- SnS: ∆Σύνολο NOx = 4 → 4 θα είναι ο συντελεστής HNO3;
- HNO3: ∆Nox = 3 → 3 θα είναι ο συντελεστής SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + ΟΧΙ + Η2Ο
Συνέχιση της εξισορρόπησης με δοκιμαστική μέθοδο:
- Εφόσον έχετε 3 Sn και 3 S στο 1ο μέλος, αυτοί θα είναι και οι συντελεστές σας στο 2ο μέλος:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Υ+ΟΧΙ+Η2Ο
- Με αυτό, το 2ο μέλος έμεινε με 12 Cl (3. 4 = 12), άρα 12 θα είναι ο συντελεστής της ουσίας στην οποία βρίσκεται το Cl στο 1ο μέλος, που είναι HCl:
3 SnS + 12 HCl + 4 ΗΝΟ3 → 3 SnCl4 + 3 S + NO +H2Ο
- Τώρα έχουμε 16 Η στο 1ο μέλος (12 + 4 = 16), εξ ου και ο συντελεστής Η2Το O θα είναι ίσο με 8, γιατί το 8 πολλαπλασιασμένο με τον δείκτη υδρογόνου, που είναι 2, δίνει 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + ΟΧΙ +8H2Ο
- Επιπλέον, στο 1ο μέλος υπάρχει επίσης 4 N, άρα 4 θα είναι επίσης ο συντελεστής του N στο 2ο μέλος:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2Ο
Σημειώστε ότι η ποσότητα οξυγόνου στο 1ο άκρο (3. 4 = 12) ισούται με τη συνολική ποσότητα αυτού του στοιχείου στο 2ο άκρο (4 + 8 = 12). Άρα η αντίδραση είναι ισορροπημένη.
Της Jennifer Fogaça
Πτυχιούχος Χημείας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε ένα σχολικό ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Αντιδράσεις με περισσότερες από μία οξείδωση και/ή αναγωγή". Σχολή Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Πρόσβαση στις 27 Ιουλίου 2021.



