Ο ζυμαρικάατομικός, όπως υποδηλώνει το όνομά του, είναι η μάζα ενός ατόμου, που συνήθως συμβολίζεται με το «mο” ή “MA”. Ωστόσο, δεδομένου ότι το άτομο είναι μια εξαιρετικά μικρή οντότητα, αόρατη στα ανθρώπινα μάτια, δεν είναι δυνατό να μετρηθεί η μάζα του χρησιμοποιώντας κλίμακες, για παράδειγμα. Έτσι οι επιστήμονες προσδιόρισαν τη μάζα των ατόμων συγκρίνοντάς τα με τις μάζες άλλων ατόμων.
Αυτό γίνεται και με τις άλλες μονάδες. Για παράδειγμα, η μονάδα μάζας είναι το τυπικό κιλό, το οποίο αντιστοιχεί σε έναν κύλινδρο ύψους και διαμέτρου 3,917 cm, κατασκευασμένο από 10% ιρίδιο και 90% πλατίνα. Χρησιμεύει λοιπόν ως σύγκριση. Για παράδειγμα, αν «ζυγίσουμε» ένα αντικείμενο σε μια ζυγαριά και διαπιστώσουμε ότι η μάζα του είναι 10 kg, αυτό σημαίνει ότι η μάζα του είναι 10 φορές μεγαλύτερη από το επιλεγμένο πρότυπο: 1 kg.
Μη σταματάς τώρα… Υπάρχουν και άλλα μετά τη διαφήμιση ;)
Το ίδιο ισχύει και για τα άτομα. Το πρότυπο που επιλέχθηκε ήταν ο άνθρακας-12, και σε αυτό το άτομο αποδόθηκε αυθαίρετα μάζα 12 u. Το «u» είναι η μονάδα ατομικής μάζας και επομένως ισοδυναμεί με το 1/12 της μάζας ενός ατόμου άνθρακα.
Για παράδειγμα, όταν λέμε ότι η ατομική μάζα του υδρογόνου είναι ίση με 1 u, σημαίνει ότι είναι σαν να αν χωρίσουμε τον άνθρακα σε 12 μέρη, η μάζα ενός από αυτά τα μέρη είναι ισοδύναμη με τη μάζα του ατόμου του υδρογόνο. Ένα άλλο παράδειγμα είναι το θείο, η ατομική του μάζα είναι 32 u, που σημαίνει ότι η μάζα του είναι 32 φορές μεγαλύτερη από το 1/12 της μάζας του 12ΝΤΟ.
1 u = 1/12 της μάζας 1 ατόμου άνθρακα 12

Η μονάδα ατομικής μάζας είναι το 1/12 της μάζας του άνθρακα-12
Η μοριακή μάζα των ουσιών είναι το άθροισμα των ατομικών μαζών των στοιχείων. Για παράδειγμα, η ατομική μάζα του οξυγόνου είναι ίση με 16 u, άρα η μοριακή μάζα του μορίου αερίου οξυγόνου (Ο2) ισούται με 32u.
Καθώς οι εργαστηριακές τεχνικές είναι επί του παρόντος πολύ προηγμένες, υπάρχουν συσκευές που μετρούν με ακρίβεια την ατομική μάζα των στοιχείων, όπως το φασματόμετρο μάζας. Έτσι, είναι δυνατόν να το γνωρίζουμε 1 u ισούται με 1,66054. 10-24 σολ.
Mind Map: Atomic Mass

*Για να κατεβάσετε τον χάρτη μυαλού σε PDF, Κάντε κλικ ΕΔΩ!
Δεδομένου ότι οι ατομικές μάζες προσδιορίζονται με μεγάλη ακρίβεια, δίνονται στον περιοδικό πίνακα με τη μορφή δεκαδικών αριθμών. Αλλά όταν πάμε να κάνουμε τους υπολογισμούς, συνήθως χρησιμοποιούμε τον στρογγυλεμένο αριθμό, με εξαίρεση τα πειράματα που πρέπει να είναι πολύ ακριβή. Για παράδειγμα, αν κοιτάξετε τον Περιοδικό Πίνακα, θα δείτε ότι η ατομική μάζα του οξυγόνου είναι ίση με 15.999 u, αλλά γενικά χρησιμοποιούμε την τιμή 16 u στους υπολογισμούς. Αυτό συμβαίνει και με τον άνθρακα, του οποίου η ατομική μάζα δίνεται με 12,01 u, όπως φαίνεται παρακάτω:
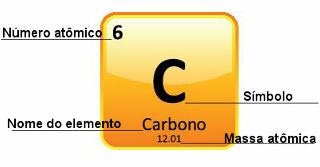
Αναπαράσταση του άνθρακα στον Περιοδικό Πίνακα
Τα στοιχεία που εμφανίζονται στον Περιοδικό Πίνακα είναι στην πραγματικότητα ο σταθμισμένος μέσος όρος όλων των φυσικών ισοτόπων του στοιχείου. Έτσι, η ατομική μάζα που εμφανίζεται στον Πίνακα είναι και ο μέσος όρος των ατομικών μαζών αυτών των στοιχείων. Για παράδειγμα, το χλώριο (C?) έχει δύο φυσικά ισότοπα, το 35 και το 37, των οποίων τα αντίστοιχα ποσοστά στη φύση είναι 75,76% και 24,24%. Οι ατομικές μάζες καθενός από αυτά τα ισότοπα είναι διαφορετικές, με αυτή του Cβ-35 να είναι 34,96885 u και εκείνη του Cβ-37 να είναι 36,96590.
Με αυτόν τον τρόπο υπολογίζεται η ατομική μάζα του στοιχείου λαμβάνοντας υπόψη τη μάζα κάθε ισοτόπου και την αφθονία με την οποία εμφανίζεται στη φύση. Στην περίπτωση του χλωρίου έχουμε:
Ατομική μάζα του στοιχείου χλώριο = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Ατομική μάζα του στοιχείου χλώριο = 35,45
Αυτή είναι η τιμή ατομικής μάζας του χλωρίου που εμφανίζεται στον Περιοδικό Πίνακα.
* Mind Map by Me. Diogo Lopes
Της Jennifer Fogaça
Πτυχιούχος Γραμμάτων

