Μεταξύ των διαμοριακών δυνάμεων, η επαγόμενες δυνάμεις διπόλων που προκαλούνται από το δίπολο είναι τα μόνα που δεν μελετήθηκαν από τον Ολλανδό φυσικό Johannes Diederik Van der Waals (1837-1923). Αποσαφηνίστηκαν από τον Γερμανό φυσικό Fritz Wolfgang London (1900-1954), έτσι οι δυνάμεις αυτές ονομάζονται επίσης δυνάμεις του Λονδίνου ή δυνάμεις διασποράς του Λονδίνου. Ένα άλλο όνομα που δόθηκε σε αυτές τις δυνάμεις είναι στιγμιαίο δίπολο επαγόμενο δίπολο.
Αυτό το είδος δύναμης εμφανίζεται σε μη πολικές ουσίες, όπως H2, O2, F2, Cl2, CO2, CH4 και C2H6, μεταξύ άλλων. Και μπορούν επίσης να εμφανιστούν μεταξύ άτομα ευγενών αερίων, όταν πλησιάζουν, προκαλώντας απώθηση μεταξύ των ηλεκτροσφαιρών τους. Με αυτόν τον τρόπο, τα ηλεκτρόνια συσσωρεύονται σε μια συγκεκριμένη πλευρά, η οποία είναι αρνητικά πολωμένη και η αντίθετη πλευρά θετικά, λόγω της έλλειψης αρνητικού φορτίου.
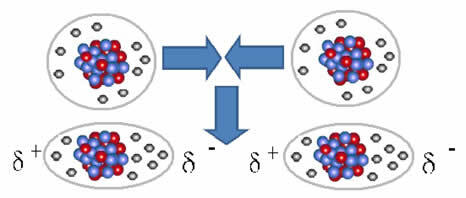
Τα μη πολικά μόρια μπορούν να περάσουν από μια αέρια κατάσταση –στην οποία απέχουν πολύ μεταξύ τους και δεν υπάρχει αλληλεπίδραση, καθώς δεν υπάρχουν πόλοι– σε υγρή και στερεή κατάσταση. Σε αυτές τις καταστάσεις συσσωμάτωσης, τα μόρια είναι πιο κοντά και οι ηλεκτρονικές έλξεις ή απωθήσεις μεταξύ των ηλεκτρονίων τους και Οι πυρήνες μπορούν να οδηγήσουν σε παραμόρφωση των ηλεκτρονικών τους νεφών, στιγμιαία, προκαλώντας θετικούς και αρνητικούς πόλους προσωρινός.
Τα στιγμιαία δίπολα μπορούν να προκαλέσουν πόλωση γειτονικών μορίων, με αποτέλεσμα ελκτικές δυνάμεις.
Αυτή η επαγωγή μπορεί επίσης να συμβεί. μεταξύ διαφορετικών μορίων και γενικά αυτές οι δυνάμεις είναι πιο αδύναμες σε ένταση από την ισχύ του διπόλου-διπόλου και του δεσμού υδρογόνου. Επομένως, στερεά με αυτή την ισχύ αλληλεπίδρασης όπως ο ξηρός πάγος (διοξείδιο του άνθρακα - CO2) και το ιώδιο (I2), που βρίσκονται σε στερεή κατάσταση, είναι υψηλά (πηγαίνουν στην αέρια κατάσταση). γιατί η ενέργεια που απαιτείται για να διαταραχθούν οι αλληλεπιδράσεις τους είναι μικρή.
Ένα παράδειγμα διαμοριακών δυνάμεων μεταξύ πολικών και μη πολικών μορίων εμφανίζεται μεταξύ αερίου οξυγόνου (μη πολικό) και νερού (πολικό). Αποδεικνύεται ότι το αρνητικό άκρο του νερού πλησιάζει το Ο2, απωθώντας τον εαυτό του, και έτσι το ηλεκτρονικό νέφος του μη πολικού μορίου απομακρύνεται. Στη συνέχεια, το οξυγόνο πολώνεται στιγμιαία και αρχίζει να αλληλεπιδρά με το νερό, διαλυτοποιώντας σε αυτό.
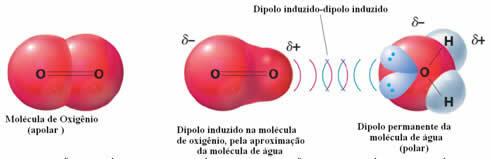
Δεδομένου ότι αυτές οι δυνάμεις είναι αδύναμες, η διαλυτότητα αυτού του αερίου στο νερό είναι μικρή. Ακόμα κι έτσι, η παρουσία του είναι απαραίτητη για τη διατήρηση της ζωής διαφόρων υδρόβιων οργανισμών.
Αυτή η δύναμη αλληλεπίδρασης εμφανίζεται επίσης στη φύση, παρέχοντας προσκόλληση μεταξύ των ποδιών των γκέκο και της επιφάνειας στην οποία περπατούν. Γι' αυτό μπορούν να περπατήσουν σε τοίχους και ταβάνια χωρίς να πέσουν ή να κολλήσουν.
Της Jennifer Fogaça
Πτυχιούχος Χημείας
Σχολική ομάδα Βραζιλίας
Πηγή: Σχολείο Βραζιλίας - https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm

