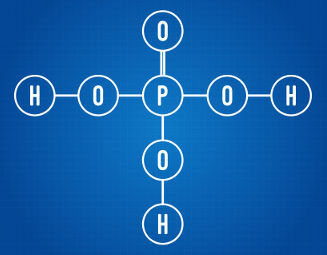
Οι ανόργανες λειτουργίες είναι ομάδες ανόργανων ενώσεων που έχουν παρόμοια χαρακτηριστικά.
Μια βασική ταξινόμηση σε σχέση με τις χημικές ενώσεις είναι: οι οργανικές ενώσεις είναι αυτές που περιέχουν άτομα άνθρακα, ενώ οι οργανικές ενώσεις περιέχουν άτομα άνθρακα. ανόργανες ενώσεις σχηματίζονται από τα άλλα χημικά στοιχεία.
Υπάρχουν εξαιρέσεις όπως CO, CO2 και συνεχώς2CO3, που παρά τον άνθρακα στη δομική φόρμουλα, έχουν χαρακτηριστικά ανόργανων ουσιών.
Οι τέσσερις κύριες ανόργανες λειτουργίες είναι: οξέα, βάσεις, άλατα και οξείδια.
Αυτές οι 4 κύριες λειτουργίες καθορίστηκαν από τον Arrhenius, έναν χημικό που αναγνώρισε τα ιόντα σε οξέα, βάσεις και άλατα.
Οξέα
Οξέα είναι ομοιοπολικές ενώσεις, δηλαδή μοιράζονται ηλεκτρόνια στους δεσμούς τους. Έχουν τη δυνατότητα ιονισμού στο νερό και σχηματίζουν φορτία, απελευθερώνοντας το H+ ως το μόνο κατιόν.
Ταξινόμηση των οξέων
Τα οξέα μπορούν να ταξινομηθούν σύμφωνα με την ποσότητα υδρογόνου που απελευθερώνεται σε ένα υδατικό διάλυμα και ιονίζεται, αντιδρώντας με νερό για να σχηματίσει το ιόν υδρονίου.
| Αριθμός ιονισμένων υδρογόνων |
|---|
|
Μονοξέα: έχουν μόνο ένα ιονίζον υδρογόνο. Παραδείγματα: HNO3, HCl και HCN |
|
διοξέα: έχετε δύο ιονίζοντα υδρογόνα. Παραδείγματα: Η2ΜΟΝΟ4Χ2S και Η2ΜΝΟ4 |
|
Τριαξέα: έχετε τρία ιονίζοντα υδρογόνα. Παραδείγματα: Η3ΣΚΟΝΗ4 και Η3BO3 |
|
τετραειδή: έχουν τέσσερα ιονίζοντα υδρογόνα. Παραδείγματα: Η4Π7Ο7 |
Η ισχύς ενός οξέος μετράται από τον βαθμό ιονισμού. Όσο υψηλότερη είναι η τιμή ισχυρότερο είναι το οξύ επειδή:
| βαθμός ιονισμού |
|---|
|
ισχυρός: έχουν βαθμό ιονισμού μεγαλύτερο από 50%. |
|
μέτριος: έχουν βαθμό ιονισμού μεταξύ 5% και 50%. |
|
αδύναμος: έχουν βαθμό ιονισμού κάτω του 5%. |
Τα οξέα μπορεί ή όχι να περιέχουν το στοιχείο οξυγόνο στη δομή τους, έτσι:
| παρουσία οξυγόνου |
|---|
|
Υδροειδή: δεν έχετε άτομα οξυγόνου. Παραδείγματα: HCl, HBr και HCN. |
|
οξυοξέα: Το στοιχείο οξυγόνο υπάρχει στη δομή οξέος. Παραδείγματα: HClO, H2CO3 και HNO3. |
Ονοματολογία οξέος
Ο γενικός τύπος ενός οξέος μπορεί να περιγραφεί ως ΗΧΟ, όπου το Α αντιπροσωπεύει το ανιόν που αποτελεί το οξύ και η ονοματολογία που δημιουργείται μπορεί να είναι:
| τερματισμός ανιόντων | Τερματισμός οξέος |
|---|---|
|
ήθος Παράδειγμα: Χλωρίδιο (Cl-) |
υδρικό Παράδειγμα: υδροχλωρικό οξύ (HCl) |
|
υποκρίνομαι Παράδειγμα: χλωρικό |
ich Παράδειγμα: χλωρικό οξύ (HClO3) |
|
πολύ Παράδειγμα: νιτρώδες |
οστό Παράδειγμα: νιτρώδες οξύ (HNO2) |
Χαρακτηριστικά οξέων
Τα κύρια χαρακτηριστικά των οξέων είναι:
- Γεύουν ξινά.
- Μεταφέρουν ηλεκτρικό ρεύμα, καθώς είναι ηλεκτρολυτικές λύσεις.
- Σχηματίζουν αέριο υδρογόνο όταν αντιδρούν με μέταλλα όπως μαγνήσιο και ψευδάργυρο.
- Σχηματίζει διοξείδιο του άνθρακα όταν αντιδρά με ανθρακικό ασβέστιο.
- Αλλάζουν τους δείκτες οξέος-βάσης σε ένα συγκεκριμένο χρώμα (το μπλε χαρτί litmus γίνεται κόκκινο).
Κύρια οξέα
Παραδείγματα: υδροχλωρικό οξύ (HCl), θειικό οξύ (Η2ΜΟΝΟ4), οξικό οξύ (CH3COOH), ανθρακικό οξύ (Η2CO3) και νιτρικό οξύ (HNO3).

Αν και το οξικό οξύ είναι ένα οξύ της Οργανικής Χημείας, είναι σημαντικό να γνωρίζουμε τη δομή του λόγω της σημασίας του.
Βάσεις
Βάσεις είναι ιοντικές ενώσεις που σχηματίζονται από κατιόντα, κυρίως μέταλλα, που διαχωρίζονται στο νερό απελευθερώνοντας το ανιόν υδροξειδίου (ΟΗ-).
Βασική ταξινόμηση
Οι βάσεις μπορούν να ταξινομηθούν σύμφωνα με τον αριθμό των υδροξυλίων που απελευθερώνονται στο διάλυμα.
| Αριθμός υδροξυλίων |
|---|
|
Μονοβάσεις: έχουν μόνο ένα υδροξύλιο. Παραδείγματα: NaOH, KOH και NH4Ω |
|
Διβάσες: έχετε δύο υδροξύλια. Παραδείγματα: Ca (OH)2, Fe (ΟΗ)2 και Mg (OH)2 |
|
Tribases: έχουν τρία υδροξύλια. Παραδείγματα: Al (OH)3 και Fe (OH)3 |
|
τετραβάσεις: έχουν τέσσερα υδροξύλια. Παραδείγματα: Sn (OH)4 και Pb (OH)4 |
Οι βάσεις είναι γενικά ιοντικές ουσίες και η ισχύς μιας βάσης μετράται από τον βαθμό αποσύνδεσης.
Όσο υψηλότερη είναι η τιμή ισχυρότερη είναι η βάση γιατί:
| βαθμός αποσύνδεσης |
|---|
|
ισχυρός: έχουν βαθμό αποσύνδεσης σχεδόν 100%. Παραδείγματα:
|
|
αδύναμος: έχετε βαθμό αποσύνδεσης κάτω από 5%. Παράδειγμα: ΝΗ4OH και Zn (OH)2. |
| Διαλυτότητα στο νερό |
|---|
|
Διαλυτός: βάσεις αλκαλίων και αμμωνίου. Παραδείγματα: Ca (OH)2, Μπα (ΟΗ)2 και ΝΗ4Ω. |
|
Ελαφρώς διαλυτό: βάσεις μετάλλων αλκαλικών γαιών. Παραδείγματα: Ca (OH)2 και Ba (OH)2. |
|
πρακτικά αδιάλυτο: άλλες βάσεις. Παραδείγματα: AgOH και Al (OH)3. |
Βασική ονοματολογία
Ο γενικός τύπος μιας βάσης μπορεί να περιγραφεί ως , όπου το B αντιπροσωπεύει τη θετική ρίζα που αποτελεί τη βάση και το y είναι το φορτίο που καθορίζει τον αριθμό των υδροξυλίων.
Η ονοματολογία για βάσεις με σταθερό φορτίο δίνεται από:
| Βάσεις με σταθερό φορτίο | ||
|---|---|---|
αλκαλι μέταλλα |
υδροξείδιο του λιθίου |
ΛΙΟΗ |
| Μέταλλα αλκαλικής γης | υδροξείδιο του μαγνησίου |
Mg (ΟΗ)2 |
Ασήμι |
υδροξείδιο του αργύρου |
AgOH |
| Ψευδάργυρος | υδροξείδιο του ψευδαργύρου | Zn (ΟΗ)2 |
| Αλουμίνιο | υδροξείδιο αργιλίου | Αλ (ΟΗ)3 |
Όταν η βάση έχει μεταβλητό φορτίο, η ονοματολογία μπορεί να είναι με δύο τρόπους:
| Βάσεις με μεταβλητό φορτίο | |||
|---|---|---|---|
| Χαλκός | Γάιδαρος+ | υδροξείδιο χαλκού Ι | CuOH |
| υδροξείδιο του χαλκού | |||
| Γάιδαρος2+ | υδροξείδιο χαλκού II | Κου (ΟΗ)2 | |
| υδροξείδιο του χαλκού | |||
| Σίδερο | Πίστη2+ | Υδροξείδιο του σιδήρου II | Φε (ΟΗ)2 |
| υδροξείδιο του σιδήρου | |||
| Πίστη3+ | Υδροξείδιο του σιδήρου III | Φε (ΟΗ)3 | |
| υδροξείδιο του σιδήρου |
Χαρακτηριστικά των βάσεων
- Οι περισσότερες βάσεις είναι αδιάλυτες στο νερό.
- Αγωγός ηλεκτρικού ρεύματος σε υδατικό διάλυμα.
- Είναι ολισθηρά.
- Αντιδρούν με οξύ για να σχηματίσουν αλάτι και νερό ως προϊόντα.
- Αλλάζουν τους δείκτες οξέος-βάσης σε ένα συγκεκριμένο χρώμα (το κόκκινο χαρτί litmus γίνεται μπλε).
Κύριες βάσεις
Οι βάσεις χρησιμοποιούνται ευρέως σε προϊόντα καθαρισμού και επίσης σε διαδικασίες χημικής βιομηχανίας.
Παραδείγματα: υδροξείδιο του νατρίου (NaOH), υδροξείδιο του μαγνησίου (Mg (OH)2), υδροξείδιο του αμμωνίου (NH4ΟΗ), υδροξείδιο αργιλίου (Al (OH)3) και υδροξείδιο του ασβεστίου (Ca (OH)2).

άλατα
άλατα είναι ιοντικές ενώσεις που έχουν τουλάχιστον ένα κατιόν διαφορετικό από Η+ και ένα ανιόν εκτός του OH-.
Ένα άλας μπορεί να ληφθεί σε μια αντίδραση εξουδετέρωσης, η οποία είναι η αντίδραση μεταξύ ενός οξέος και μιας βάσης.
Η αντίδραση υδροχλωρικού οξέος με υδροξείδιο νατρίου παράγει χλωριούχο νάτριο και νερό.
Το σχηματιζόμενο άλας αποτελείται από το ανιόν οξέος (Cl-) και από το κατιόν βάσης (Na+).
Ταξινόμηση των αλάτων
Παρακάτω, έχουμε τις κύριες οικογένειες αλάτων που μπορούν να ταξινομηθούν σύμφωνα με τη διαλυτότητα στο νερό και την αλλαγή του pH του διαλύματος ως εξής:
| Υδατοδιαλυτότητα των πιο κοινών αλάτων | |||
|---|---|---|---|
| Διαλυτός | Νιτρικά άλατα | Εξαιρέσεις: Οξικός άργυρος. |
|
| Χλωρικά | |||
Οξεικά |
|||
| Χλωρίδια | Εξαιρέσεις: |
||
| Βρωμίδες | |||
| Ιωδίδης | |||
| Θειικά |
Εξαιρέσεις: |
||
| Αδιάλυτος | Σουλφίδια |
Εξαιρέσεις: αλκαλική γη και αμμώνιο. |
|
| Ανθρακικά | Εξαιρέσεις: Τα αλκαλικά μέταλλα και το αμμώνιο. |
||
| Φωσφορικά |
| pH | |
|---|---|
| ουδέτερα άλατα |
Όταν διαλύονται σε νερό δεν αλλάζουν το pH. Παράδειγμα: NaCl. |
| όξινα άλατα |
Όταν διαλύονται σε νερό κάνουν το διάλυμα pH μικρότερο από 7. Παράδειγμα: ΝΗ4Κλ. |
| βασικά άλατα |
Όταν διαλύονται σε νερό κάνουν το διάλυμα pH μεγαλύτερο από 7. Παράδειγμα: CH3ΚΟΝΑ. |
Εκτός από τις οικογένειες αλατιού που είδαμε νωρίτερα, υπάρχουν και άλλοι τύποι αλάτων, όπως φαίνεται στον παρακάτω πίνακα.
| Άλλοι τύποι αλάτων | |
|---|---|
| άλατα υδρογόνου | Παράδειγμα: NaHCO3 |
| Υδροξυ-άλατα | Παράδειγμα: Al (OH)2Κλ |
| διπλά άλατα | Παράδειγμα: KNaSO4 |
| ενυδατωμένα άλατα | Παράδειγμα: CuSO4. 5 ώρες2Ο |
| σύνθετα άλατα | Παράδειγμα: [Cu (NH3)4]ΜΟΝΟ4 |
Ονοματολογία αλάτων
Γενικά, η ονοματολογία ενός άλατος ακολουθεί την ακόλουθη σειρά:
| όνομα ανιόν | όνομα κατιόντος | όνομα αλατιού |
|---|---|---|
|
Κλ- Χλωριούχο |
Πίστη3+ Σίδηρος III |
FeCl3 Χλωριούχο σίδηρο III |
|
Θειικό άλας |
Στο+ Νάτριο |
Στο2ΜΟΝΟ4 Θειικό νάτριο |
|
Νιτρώδες αλάτι |
κ+ Κάλιο |
ΚΝΟ2 Νιτρώδες κάλιο |
|
αδερ- Βρωμιούχο |
Εδώ2+ Ασβέστιο |
CaBr2 βρωμιούχο ασβέστιο |
Χαρακτηριστικά αλάτων
- Είναι ιονικές ενώσεις.
- Είναι στερεά και κρυσταλλικά.
- Υποφέρετε από βρασμό σε υψηλές θερμοκρασίες.
- Αγωγός ηλεκτρικού ρεύματος σε διάλυμα.
- Γεύουν αλμυρά.
Κύρια άλατα
Παραδείγματα: νιτρικό κάλιο (KNO3), υποχλωριώδες νάτριο (NaClO), φθοριούχο νάτριο (NaF), ανθρακικό νάτριο (Na2CO3) και θειικό ασβέστιο (CaSO4).

Οξείδια
Οξείδια είναι δυαδικές ενώσεις (ιονικές ή μοριακές) που έχουν δύο στοιχεία. Έχουν οξυγόνο στη σύνθεσή τους, το οποίο είναι το πιο ηλεκτροαρνητικό τους στοιχείο.
Ο γενικός τύπος για ένα οξείδιο είναι , όπου C είναι το κατιόν και το φορτίο του γ γίνεται δείκτης στο οξείδιο που σχηματίζει την ένωση:
Ταξινόμηση των οξειδίων
| Σύμφωνα με χημικούς δεσμούς | |
|---|---|
| ιωνικός |
Συνδυασμός οξυγόνου με μέταλλα. Παράδειγμα: ZnO. |
| Μοριακός |
Συνδυασμός οξυγόνου με μη μεταλλικά στοιχεία. Παράδειγμα: OS2. |
| Σύμφωνα με τις ιδιότητες | |
|---|---|
| Βασικά |
Σε υδατικό διάλυμα αλλάζουν το pH σε μεγαλύτερο από 7. Παράδειγμα: Διάβασα2O (και άλλα μέταλλα αλκαλίων και αλκαλικών γαιών). |
| Οξέα |
Σε υδατικό διάλυμα αντιδρούν με νερό και σχηματίζουν οξέα. Παραδείγματα: CO2, ΜΟΝΟ3 και όχι2. |
| Ουδέτερα |
Μερικά οξείδια που δεν αντιδρούν με νερό. Παράδειγμα: CO. |
| Υπεροξείδια |
Σε υδατικό διάλυμα αντιδρούν με νερό ή αραιωμένα οξέα και σχηματίζουν υπεροξείδιο υδρογόνου Η2Ο2. Παράδειγμα: Na2Ο2. |
| Αμφοτερ |
Μπορούν να συμπεριφέρονται σαν οξέα ή βάσεις. Παράδειγμα: ZnO. |
Ονοματολογία οξειδίων
Γενικά, η ονοματολογία ενός οξειδίου ακολουθεί την ακόλουθη σειρά:
| Ονομασία ανάλογα με τον τύπο οξειδίου | |
|---|---|
| ιοντικά οξείδια |
Παραδείγματα οξειδίων σταθερού φορτίου: CaO - οξείδιο του ασβεστίου Αλ2Ο3 - οξείδιο αργιλίου |
|
Παραδείγματα οξειδίων με μεταβλητό φορτίο: FeO - Οξείδιο του σιδήρου II Πίστη2Ο3 - Οξείδιο του σιδήρου III | |
| μοριακά οξείδια |
Παραδείγματα: CO - μονοξείδιο του άνθρακα Ν2Ο5 - Πεντοξείδιο του αζώτου |
Χαρακτηριστικά οξειδίου
- Είναι δυαδικές ουσίες.
- Σχηματίζονται με τη σύνδεση οξυγόνου με άλλα στοιχεία, εκτός από το φθόριο.
- Τα μεταλλικά οξείδια, όταν αντιδρούν με οξέα, σχηματίζουν αλάτι και νερό.
- Τα μη μεταλλικά οξείδια, όταν αντιδρούν με βάσεις, σχηματίζουν αλάτι και νερό.
Κύρια οξείδια
Παραδείγματα: οξείδιο του ασβεστίου (CaO), οξείδιο του μαγγανίου (MnO2), οξείδιο κασσιτέρου (SnO2), οξείδιο του σιδήρου III (Fe2Ο3) και οξείδιο αργιλίου (Al2CO3).

Ασκήσεις Εξετάσεων Είσοδος
1. (UEMA / 2015) ΟΧΙ2και το λειτουργικό σύστημα2 είναι αέρια που προκαλούν ατμοσφαιρική ρύπανση που, μεταξύ των ζημιών που προκαλούνται, έχουν ως αποτέλεσμα τη δημιουργία όξινης βροχής όταν αυτά τα αέρια αντιδρούν με σωματίδια νερού που υπάρχουν στα σύννεφα, παράγοντας HNO3 και Η2ΜΟΝΟ4.
Αυτές οι ενώσεις, όταν μεταφέρονται με ατμοσφαιρική βροχόπτωση, προκαλούν διαταραχές, όπως μόλυνση του πόσιμου νερού, διάβρωση οχημάτων, ιστορικά μνημεία κ.λπ.
Οι ανόργανες ενώσεις που αναφέρονται στο κείμενο αντιστοιχούν αντίστοιχα στις συναρτήσεις:
α) άλατα και οξείδια
β) βάσεις και άλατα
γ) οξέα και βάσεις
δ) βάσεις και οξείδια
ε) οξείδια και οξέα
Σωστή εναλλακτική λύση: ε) οξείδια και οξέα.

Τα οξείδια είναι ενώσεις που σχηματίζονται από οξυγόνο και άλλα στοιχεία, εκτός από το φθόριο.
Τα οξέα, όταν έρχονται σε επαφή με το νερό, υφίστανται ιονισμό και παράγουν το ιόν υδρονίου. Για τα εν λόγω οξέα, έχουμε τις ακόλουθες αντιδράσεις:
το HNO3 Είναι μονοοξύ επειδή έχει μόνο ένα ιονισμένο υδρογόνο. το Η2ΜΟΝΟ4 Είναι ένα διοξύ επειδή έχει δύο ιονίζοντα υδρογόνα.
Οι άλλες ανόργανες συναρτήσεις που υπάρχουν στις ερωτήσεις αντιστοιχούν σε:
Βάσεις: ιόντα υδροξυλίου (ΟΗ-) συνδέεται ιονικά με μεταλλικά κατιόντα.
Άλατα: προϊόν της αντίδρασης εξουδετέρωσης μεταξύ οξέος και βάσης.
Μάθε περισσότερα γιαχημικές λειτουργίες.
2. (UNEMAT / 2012) Χρησιμοποιούμε διάφορα χημικά προϊόντα στην καθημερινή μας ζωή, όπως γάλα μαγνησίου, ξύδι, ασβεστόλιθο και καυστική σόδα.
Είναι σωστό να δηλώνεται ότι αυτές οι ουσίες που αναφέρονται ανήκουν, αντίστοιχα, στις χημικές λειτουργίες:
α) οξύ, βάση, αλάτι και βάση
β) βάση, αλάτι, οξύ και βάση
γ) βάση, οξύ, αλάτι και βάση
δ) οξύ, βάση, βάση και αλάτι
ε) αλάτι, οξύ, αλάτι και βάση
Σωστή εναλλακτική λύση: γ) βάση, οξύ, αλάτι και βάση.
Το γάλα μαγνησίου, ο ασβεστόλιθος και η καυστική σόδα είναι παραδείγματα ενώσεων που περιέχουν ανόργανες λειτουργίες στις δομές τους.
Το ξίδι είναι μια οργανική ένωση που σχηματίζεται από ένα ασθενές καρβοξυλικό οξύ.
Στον παρακάτω πίνακα μπορούμε να παρατηρήσουμε τις δομές καθεμιάς από αυτές και τις χημικές λειτουργίες που τις χαρακτηρίζουν.
| Προϊόν | Γάλα μαγνησίου | Ξύδι | Ασβεστόλιθος | Καυστική σόδα |
|---|---|---|---|---|
| Χημικό λίπασμα | υδροξείδιο του μαγνησίου | Οξικό οξύ | Ανθρακικό ασβέστιο | Υδροξείδιο του νατρίου |
| Τύπος | ||||
| χημική λειτουργία | Βάση | καρβοξυλικό οξύ | άλας | Βάση |
Το γάλα μαγνησίου είναι ένα εναιώρημα υδροξειδίου του μαγνησίου που χρησιμοποιείται για τη θεραπεία του οξέος του στομάχου, καθώς αντιδρά με υδροχλωρικό οξύ από το γαστρικό χυμό.
Το ξίδι είναι ένα ευρέως χρησιμοποιούμενο καρύκευμα κυρίως στην παρασκευή τροφίμων λόγω του αρώματος και της γεύσης του.
Ο ασβεστόλιθος είναι ένας ιζηματογενής βράχος, του οποίου το κύριο μετάλλευμα είναι ασβεστίτης, που περιέχει μεγάλες ποσότητες ανθρακικού ασβεστίου.
Η καυστική σόδα είναι η εμπορική ονομασία για το υδροξείδιο του νατρίου, μια ισχυρή βάση που χρησιμοποιείται σε πολλές βιομηχανικές διαδικασίες και οικιακή χρήση για να ξεμπλοκάρει σωλήνες λόγω συσσώρευσης λαδιών και λιπών.
3. (UDESC / 2008) Όσον αφορά το υδροχλωρικό οξύ, μπορεί να ειπωθεί ότι:
α) όταν βρίσκεται σε υδατικό διάλυμα, επιτρέπει τη διέλευση ηλεκτρικού ρεύματος
β) είναι ένα διοξύ
γ) είναι ασθενές οξύ
δ) έχει χαμηλό βαθμό ιονισμού
ε) είναι μια ιοντική ουσία
Σωστή εναλλακτική λύση: α) όταν βρίσκεται σε υδατικό διάλυμα, επιτρέπει τη διέλευση ηλεκτρικού ρεύματος.
Το υδροχλωρικό οξύ είναι ένα μονοοξύ καθώς έχει μόνο ένα ιονισμένο υδρογόνο.
Είναι μια μοριακή ένωση, με υψηλό βαθμό ιονισμού και επομένως είναι ένα ισχυρό οξύ, το οποίο, όταν συνάπτεται με το νερό, διασπά το μόριό του σε ιόντα ως εξής:
Όπως παρατήρησε ο Arrhenius στα πειράματά του, τα θετικά ιόντα που σχηματίστηκαν κατά τον ιονισμό κινούνται προς τον αρνητικό πόλο, ενώ τα αρνητικά ιόντα κινούνται προς τον θετικό πόλο.
Με αυτόν τον τρόπο, ρέει ηλεκτρικό ρεύμα στο διάλυμα.
Για περισσότερα ζητήματα με σχολιασμένη επίλυση, δείτε επίσης: ασκήσεις σε ανόργανες λειτουργίες.