Στο κείμενο "Πώς λειτουργούν οι καταλυτικές ουσίες;Έχει αποδειχθεί ότι οι καταλύτες είναι σε θέση να αυξήσουν την ταχύτητα των αντιδράσεων επειδή μειώνουν την ενέργεια ενεργοποίησης που απαιτείται για την αντίδραση. Αυτό το κάνουν αλλάζοντας τον μηχανισμό αντίδρασης, συνδυάζοντας με τα αντιδραστήρια και σχηματίζοντας μια ενδιάμεση ένωση, η οποία με τη σειρά της γίνεται προϊόντα και καταλύτης.
Ένας από τους τρόπους για να συμβεί αυτό ονομάζεται Ομογενής κατάλυση, που είναι όταν ο καταλύτης σχηματίζει ένα μονοφασικό σύστημα με τα αντιδραστήρια.
Αυτό σημαίνει ότι όλα τα αντιδραστήρια, τα προϊόντα και ο καταλύτης πρέπει να βρίσκονται στην ίδια φάση, δηλαδή στην ίδια φυσική κατάσταση.
Η μελέτη αυτού του τύπου κατάλυσης είναι σημαντική για την επιστήμη και τη βιομηχανία, καθώς πολλές σημαντικές αντιδράσεις για την παραγωγή μπορούν να επιταχυνθούν με μικρές ποσότητες καταλυτών.
Ένα παράδειγμα ομοιογενούς κατάλυσης που χρησιμοποιείται στη βιομηχανία είναι ένα ενδιάμεσο στάδιο στην παραγωγή θειικού οξέος (Η
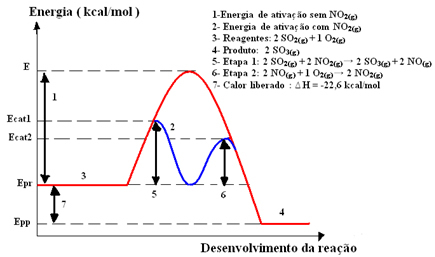
2ΜΟΝΟ4 (υδ)), στον οποίο σχηματίζεται το τριοξείδιο του θείου (SO3 (ζ)) μέσω της αντίδρασης καύσης διοξειδίου του θείου (SO2 (ζ)), Φαίνεται παρακάτω:2 Ω2 (ζ) + Ο2 (ζ) → 2 λειτουργικό σύστημα3 (ζ)
Αυτή η αντίδραση προχωρά πολύ αργά, έτσι προστίθεται ένας καταλύτης, διοξείδιο του αζώτου (ΝΟ).2 (ζ)). Αυτός ο καταλύτης συνδυάζεται με διοξείδιο του θείου για να σχηματίσει μια ενδιάμεση ένωση (ενεργοποιημένο σύμπλοκο), το οποίο είναι μονοξείδιο του αζώτου (ΟΧΙ(σολ)).
Αυτή η ενδιάμεση ένωση στη συνέχεια αντιδρά με αέριο οξυγόνο (Ο2 (ζ)) για την αναγέννηση του καταλύτη. Δείτε παρακάτω πώς συμβαίνει αυτό και παρατηρήστε πώς βρίσκονται όλα στη φάση αερίου, σχηματίζοντας ένα ομοιογενές μέσο:
καταλύτηςενεργοποιήθηκε το σύμπλεγμα
Βήμα 1: 2 OS2 (ζ) + 2 ΟΧΙ2 (ζ)→ 2 λειτουργικό σύστημα3 (ζ) + 2 ΟΧΙ(σολ)
Βήμα 2: 2 ΟΧΙ(σολ)+ 1 Ο2 (ζ) → 2 ΟΧΙ2 (ζ)
Παγκόσμια αντίδραση: 2 SO2 (ζ) + Ο2 (ζ) → 2 λειτουργικό σύστημα3 (ζ)
Σημειώστε ότι ο καταλύτης συμμετέχει μόνο στα ενδιάμεσα στάδια, αλλά δεν καταναλώνεται. Στο τέλος της αντίδρασης, αναρρώνεται πλήρως. Η αντίδραση με αυτόν τον μηχανισμό που γίνεται σε δύο στάδια απαιτεί λιγότερη ενέργεια ενεργοποίησης και, επομένως, προχωρά πιο γρήγορα.
Γραφική αναπαράσταση:
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/catalise-homogenea.htm
