Όταν λέμε τη λέξη «ισορροπία», ένα αντικείμενο που παραμένει επ 'αόριστον έρχεται στο μυαλό. Ωστόσο, αυτό είναι μόνο ένα είδος ισορροπίας, που ονομάζεται «Στατική ισορροπία».
Υπάρχει επίσης το "δυναμική ισορροπία". Σε αυτό, όπως λέει το όνομα, δεν υπάρχει ούτε μία στιγμή κατά την οποία το εν λόγω αντικείμενο ή φαινόμενο παραμένει. Για παράδειγμα, για να καταλάβετε, δείτε την παρακάτω εικόνα και σημειώστε ότι η ποσότητα νερού που πέφτει στο δοχείο είναι ίση με την ποσότητα που ρέει από αυτό, διατηρώντας τη στάθμη του νερού σταθερή. Σε αυτήν την περίπτωση, λέμε ότι υπάρχει δυναμική ισορροπία, μια ισορροπία σε κίνηση.

Αυτό το είδος ισορροπίας συμβαίνει αναστρέψιμες αντιδράσεις, δηλαδή, σε εκείνες τις αντιδράσεις που συμβαίνουν και στις δύο κατευθύνσεις. Την ίδια στιγμή που τα μόρια των αντιδραστηρίων μετασχηματίζονται στα προϊόντα, τα μόρια των προϊόντων αντιδρούν μεταξύ τους για να σχηματίσουν τα αντιδραστήρια. Η αντιστρεψιμότητα μιας αντίδρασης αντιπροσωπεύεται από βέλη και προς τις δύο κατευθύνσεις:
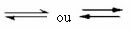
Όταν ο ρυθμός ανάπτυξης της άμεσης αντίδρασης (σχηματισμού των προϊόντων) είναι ίσος με τον ρυθμό ανάπτυξης του αντίστροφη αντίδραση (σχηματισμός αντιδραστηρίων), υπό σταθερή θερμοκρασία, σημαίνει ότι η αντίδραση έχει φτάσει στην ισορροπία της χημική ουσία. Και στην περίπτωση αντιδράσεων με την παρουσία μόνο μορίων στα αντιδραστήρια και τα προϊόντα, έχουμε ένα μοριακή ισορροπία.
Το παρακάτω είναι ένα παράδειγμα της αντίδρασης που συμβαίνει μεταξύ του αερίου υδρογόνου (Η2) και αέριο ιώδιο (I2), για το σχηματισμό αερίου ιωδιούχου υδρογόνου (HI):
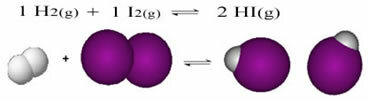
Στην αρχή της αντίδρασης, ο ρυθμός ανάπτυξης της άμεσης αντίδρασης ήταν υψηλότερος, αφού όλη η συγκέντρωση των αντιδρώντων ήταν μέγιστη και εκείνη των προϊόντων ήταν μηδέν. Έτσι, ο ρυθμός ανάπτυξης της αντίστροφης αντίδρασης ήταν επίσης μηδέν.
Ωστόσο, με την πάροδο του χρόνου, τα αέρια υδρογόνου και ιωδίου αντιδρούν, δημιουργώντας το προϊόν. Με αυτόν τον τρόπο, η συγκέντρωση των αντιδραστηρίων αρχίζει να μειώνεται και ο ρυθμός ανάπτυξής τους επίσης μειώνεται.
Καθώς η συγκέντρωση των προϊόντων αυξάνεται και η συγκέντρωση των αντιδρώντων μειώνεται, ο ρυθμός ανάπτυξης της αντίστροφης αντίδρασης αρχίζει να αυξάνεται. Εάν η θερμοκρασία διατηρηθεί σταθερή, θα έρθει μια στιγμή που οι δύο ρυθμοί ανάπτυξης θα παραμείνουν οι ίδιοι, δείχνοντας έτσι ότι η αντίδραση έχει φτάσει σε χημική μοριακή ισορροπία.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm
