Ομοιοπολικό δεσμό είναι ένας τύπος αλληλεπίδρασης μεταξύ ατόμων που έχουν υψηλή ηλεκτροαρνητικότητα, δηλαδή, υψηλή τάση λήψης ηλεκτρονίων. Τα χημικά στοιχεία που εμπλέκονται συνήθως σε αυτόν τον τύπο δεσμού είναι:
Υδρογόνο (Η)
Βηρύλλιο (Be)
Βόριο (Β)
Άνθρακας (C)
Άζωτο (N)
Φώσφορος (Ρ)
Οξυγόνο (O)
Θείο (S)
Φθόριο (F)
Χλώριο (Cl)
Βρώμιο (Br)
Ιώδιο (Ι)
α) Φύση των σχετικών στοιχείων
Τα χημικά στοιχεία που έχουν υψηλή ηλεκτροαρνητικότητα και, κατά συνέπεια, φέρουν ομοιοπολικούς δεσμούς είναι:
Υδρογόνο
Ametals
β) Εμφάνιση ομοιοπολικού δεσμού
Ανάλογα με τη φύση των χημικών στοιχείων που εμπλέκονται στον ομοιοπολικό δεσμό, μπορεί να συμβεί ως εξής:
Μεταξύ δύο ατόμων υδρογόνου.
Μεταξύ ενός μη μεταλλικού ατόμου και υδρογόνου.
Μεταξύ ατόμων του ίδιου χημικού στοιχείου (μη μέταλλο).
Μεταξύ ατόμων διαφορετικών χημικών στοιχείων (και τα δύο μη μέταλλα).
γ) Αριθμός ηλεκτρονίων που πρέπει να λαμβάνει κάθε άτομο
Ο αριθμός ηλεκτρονίων που λαμβάνει κάθε άτομο μη μετάλλου ή υδρογόνου σε έναν δεσμό σχετίζεται με το κανόνας οκτάδας.
Σύμφωνα με τον κανόνα οκτάδας, ένα άτομο είναι σταθερό όταν αποκτά οκτώ ή δύο ηλεκτρόνια (μόνο στην περίπτωση του υδρογόνου) στο κέλυφος σθένους. Εάν ένα άτομο έχει πέντε ηλεκτρόνια στο κέλυφος σθένους του, για παράδειγμα, πρέπει να λάβει τρία ηλεκτρόνια για να επιτύχει σταθερότητα.
ΣΗΜΕΙΩΣΗ: Το βηρύλλιο και το βόριο είναι εξαιρέσεις στον κανόνα οκτάδας, καθώς γίνονται σταθερά, αντίστοιχα, με 4 και 6 ηλεκτρόνια στο κέλυφος σθένους.
Ο αριθμός ηλεκτρονίων στο κέλυφος σθένους μπορεί εύκολα να προσδιοριστεί αναλύοντας την οικογένεια χημικών στοιχείων. Στον παρακάτω πίνακα, έχουμε τον αριθμό ηλεκτρονίων στο κέλυφος σθένους που αναφέρεται στην οικογένεια στην οποία ανήκει το στοιχείο και τον αριθμό ηλεκτρονίων που πρέπει να λάβει για να επιτύχει σταθερότητα:

δ) Αρχή ομοιοπολικού δεσμού
Όπως στον ομοιοπολικό δεσμό, όλα τα εμπλεκόμενα άτομα έχουν την τάση να δέχονται ηλεκτρόνια, υποχρεωτικά, θα υπάρχει μεταξύ τους μια κατανομή των ηλεκτρονίων που υπάρχουν στο κέλυφος σθένους (το επίπεδο πιο μακριά από τον πυρήνα).
Η κοινή χρήση συμβαίνει όταν ένα ηλεκτρόνιο από το κέλυφος σθένους ενός ατόμου γίνεται μέρος του ίδιου ηλεκτρονικού σύννεφου που περιβάλλει ένα άλλο ηλεκτρόνιο από το κέλυφος σθένους ενός άλλου ατόμου.
Κάθε άτομο υδρογόνου, για παράδειγμα, έχει ένα ηλεκτρόνιο στο κέλυφος σθένους. Όταν δύο ηλεκτρόνια γίνονται μέρος του ίδιου νέφους, κάθε Υδρογόνο αρχίζει να έχει δύο ηλεκτρόνια σθένους, δηλαδή σταθεροποιείται.
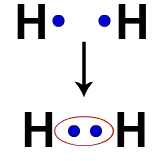
Ηλεκτρόνια δύο ατόμων υδρογόνου που καταλαμβάνουν το ίδιο νέφος ηλεκτρονίων
ε) Τύποι που χρησιμοποιούνται στην ομοιοπολική σύνδεση
1ª) μοριακός τύπος
Είναι η ένδειξη του αριθμού ατόμων κάθε στοιχείου που σχηματίζουν το μόριο που προέρχεται από ομοιοπολικούς δεσμούς.
Παράδειγμα: Η2Ο
Στο μόριο του νερού, έχουμε 2 άτομα υδρογόνου και 1 άτομο οξυγόνου.
2ª) συντακτικός τύπος
Ο δομικός τύπος είναι η επίδειξη της οργάνωσης του μορίου, δηλαδή δείχνει τους δεσμούς μεταξύ των ατόμων. Για αυτό, χρησιμοποιούνται παύλες που αντιπροσωπεύουν τον δεσμό κάθε ατόμου:
Απλή (?): Υποδεικνύει ότι το άτομο μοιράστηκε μόνο ένα ηλεκτρόνιο από το κέλυφος σθένους με ένα άλλο άτομο και αντίστροφα.
Διπλό (?): Υποδεικνύει ότι το άτομο μοιράστηκε δύο ηλεκτρόνια από το κέλυφος σθένους με το άλλο άτομο και αντίστροφα.
Τριπλό (≡): Υποδεικνύει ότι το άτομο έχει μοιραστεί τρία ηλεκτρόνια από το κέλυφος σθένους με ένα άλλο άτομο και το αντίστροφο.
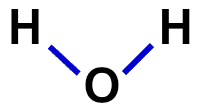
Δομικός τύπος νερού
3ª) Η ηλεκτρονική φόρμουλα του Lewis
Ο ηλεκτρονικός τύπος Lewis αντιπροσωπεύει επίσης την οργάνωση του μορίου (ηλεκτρονικός τύπος), αλλά στοχεύει στην επίδειξη της κατανομής των ηλεκτρονίων στα άτομα.
Για να το φτιάξετε, αρκεί να σέβεστε τον οργανισμό που προτείνεται σε μια δομική φόρμουλα και να αντικαθιστάτε κάθε ίχνος των δεσμών (μονός, διπλός ή τριπλός) από «δύο μπάλες», που αντιπροσωπεύουν τα ηλεκτρόνια.
Στη δομική φόρμουλα του νερού, για παράδειγμα, έχουμε δύο απλούς δεσμούς μεταξύ των υδρογόνων και του οξυγόνου. Έτσι, μεταξύ τους, θα έχουμε μόνο δύο μπάλες, που οριοθετούνται από μια έλλειψη (που αντιπροσωπεύει το ηλεκτρονικό σύννεφο).
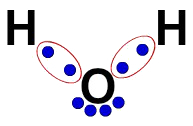
Η ηλεκτρονική φόρμουλα του Lewis για το νερό
Από μένα. Diogo Lopes Dias
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm
