Υδρογονάνθρακες, που ονομάζεται επίσης καρβίδια υδρογόνου, είναι οργανικές ενώσεις των οποίων η σύνθεση έχει μόνο άτομα άνθρακας (C) και από υδρογόνο (Η), έχοντας έτσι τον γενικό τύπο ΓΧΗε.
Ένας υδρογονάνθρακας αποτελείται από μια δομή άνθρακα στην οποία συνδέονται άτομα υδρογόνου ομοιοπολικό δεσμό.
Είναι η πιο σημαντική ένωση στην οργανική χημεία.
Όλοι οι τύποι υδρογονανθράκων οξειδώνονται εύκολα, απελευθερώνοντας έτσι τη θερμότητα. Τα περισσότερα από αυτά δεν είναι υδατοδιαλυτά.
Οι φυσικοί υδρογονάνθρακες είναι χημικές ενώσεις που σχηματίζονται στο εσωτερικό της Γης (πάνω από 150 χλμ. Από) βάθος) σε περιοχές υψηλής πίεσης και ζώνης χαμηλότερης πίεσης μέσω γεωλογικών διεργασιών.
Πού βρίσκονται οι υδρογονάνθρακες;
Η κύρια πηγή υδρογονανθράκων είναι το λάδι. Εξαιτίας αυτού, ο υδρογονάνθρακας υπάρχει σε πολλά παράγωγα όπως πετρέλαιο, παραφίνη, φυσικό αέριο, Βενζίνη, Βαζελίνη, ντίζελ, Υγραέριο (Υγροποιημένο πετρέλαιο), πολυμερή (όπως πλαστικό και καουτσούκ), μεταξύ άλλων.
Αυτή η οργανική ένωση αποτελεί το 48% της ενεργειακής μήτρας της Βραζιλίας.
Η ανθρακική αλυσίδα που αποτελεί μέρος της σύνθεσης ενός υδρογονάνθρακα είναι τετρασθενής, δηλαδή, μπορεί να κάνει τέσσερις συνδέσεις.
Ο άνθρακας μπορεί να συνδεθεί με άλλα άτομα άνθρακα και με υδρογόνα απλοί σύνδεσμοι, διπλασιάζει ή τριπλάσια.
Ταξινόμηση υδρογονανθράκων
Η ταξινόμηση των υδρογονανθράκων βασίζεται σε τρεις ειδικότητες: α μορφή της κύριας αλυσίδας άνθρακα, το Συνδέσεις των αλυσίδων άνθρακα, το παρουσία αλκυλ ριζών στην αλυσίδα άνθρακα και παρουσία ετεροάτομων διαιρώντας την ανθρακική αλυσίδα.
μάθετε περισσότερα για υδρογόνο.
Κύριο σχήμα αλυσίδας άνθρακα
Όσον αφορά το σχήμα της κύριας αλυσίδας άνθρακα, η ταξινόμηση των υδρογονανθράκων υποδιαιρείται σε αλιφατικός και κυκλικός.
Δείτε τι αποτελείται από κάθε μία από αυτές τις μορφές αλυσίδας άνθρακα.
αλειφατικοί υδρογονάνθρακες
Οι αλειφατικοί υδρογονάνθρακες σχηματίζονται από αλυσίδες άνθρακα Άνοιξε ή απεριοδικός. Σε αυτές τις αλυσίδες, οι άνθρακες είναι ακροδέκτες.
Παραδείγματα:
αλκανίου
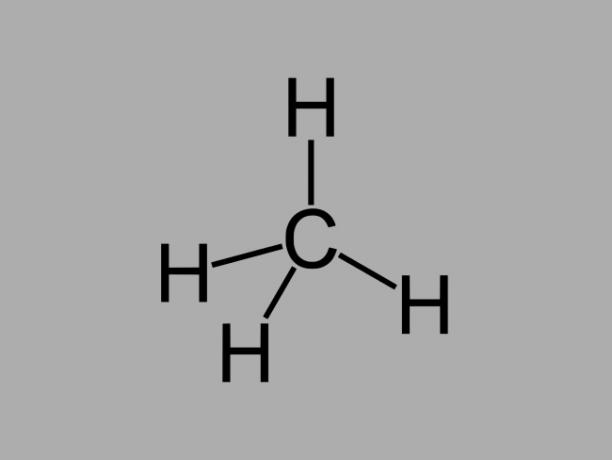
Οι υδρογονάνθρακες αλκανίου, που ονομάζονται επίσης παραφίνες ή εκ παραφίνης, είναι λιπαρές ενώσεις όπου υπάρχουν μόνο μεμονωμένοι δεσμοί μεταξύ άνθρακα.
Ο γενικός τύπος για ένα αλκάνιο είναι CόχιΗ2όχι + 2 (n = οποιοσδήποτε ακέραιος αριθμός).
αλκένιο
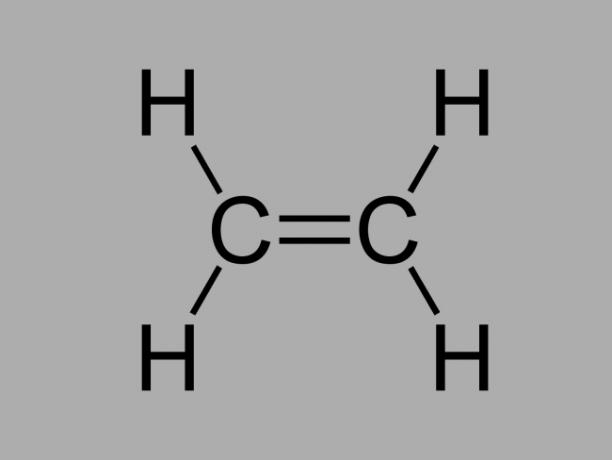
Επίσης λέγεται ολεφίνη, αλκένιο ή υδρογονάνθρακα αιθυλενίου, το αλκένιο είναι μια κακώς αντιδραστική ένωση όπου υπάρχει ένας διπλός δεσμός μεταξύ των ανθράκων.
Ο γενικός τύπος για ένα αλκένιο είναι CόχιΗ2όχι.
αλκύνιο
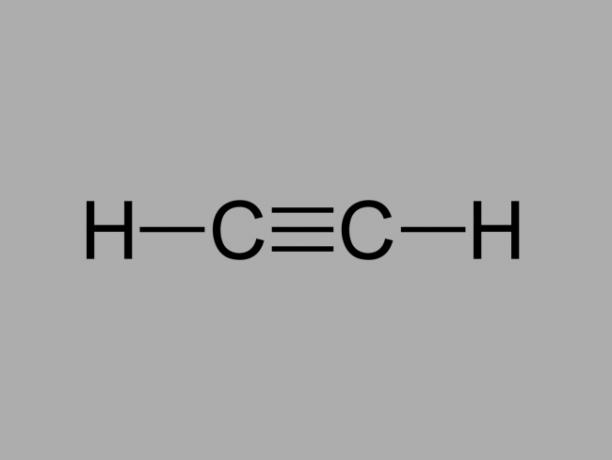
Επίσης λέγεται μεθυλακετυλένιο, το alkyne είναι ένας υδρογονάνθρακας όπου οι υφιστάμενοι δεσμοί μεταξύ των ανθράκων είναι τριπλοί.
Ο γενικός τύπος για ένα αλκύνιο είναι CόχιΗ2όχι-2.
αλκαδιένιο

Επίσης ονομάζονται διένια ή διολεφίνες, τα αλκαδιένια είναι υδρογονάνθρακες όπου οι δεσμοί μεταξύ των ανθράκων είναι διπλοί.
Ο γενικός τύπος για ένα αλκαδιένιο είναι CόχιΗ2όχι-2.
Κυκλικοί υδρογονάνθρακες
Οι κυκλικοί υδρογονάνθρακες σχηματίζονται από κλειστές ή κυκλικές αλυσίδες άνθρακα. Αυτές οι αλυσίδες δεν έχουν τερματικούς άνθρακες.
Παραδείγματα:
Κυκλάν
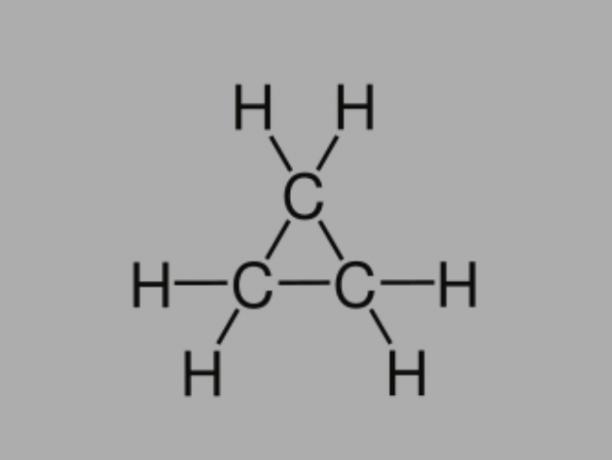
Επίσης λέγεται κυκλοαλκανίου, κυκλοπαραφίνη ή ναφθενικός υδρογονάνθρακας, το κυκλάνιο είναι ένας κορεσμένος υδρογονάνθρακας, που αποτελείται από απλούς δεσμούς.
Έχει μια κλειστή αλυσίδα άνθρακα και ο γενικός τύπος της είναι CόχιΗ2όχι.
Κυκλωνικός

Επίσης λέγεται κυκλοαλκένες, τα κυκλένια είναι ακόρεστοι υδρογονάνθρακες, αποτελούμενοι από διπλούς δεσμούς.
Ένα κυκλένιο έχει μια κλειστή αλυσίδα άνθρακα και ο γενικός τύπος του είναι CόχιΗ2όχι−2.
ποδηλάτης
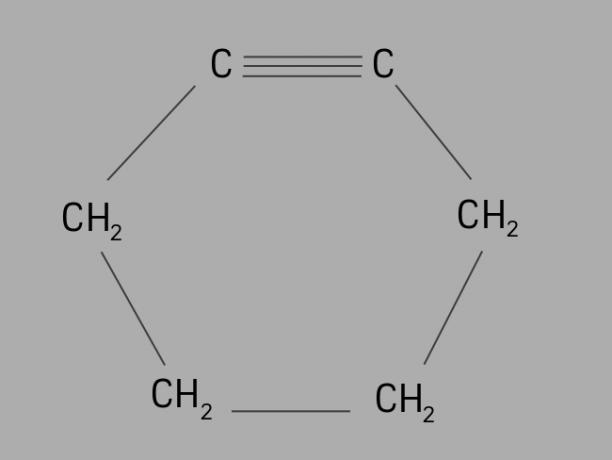
Επίσης λέγεται κυκλοαλκίνη ή κυκλοαλκίνη, η κυκλίνη είναι ένας κυκλικός και ακόρεστος υδρογονάνθρακας.
Σχηματίζεται από μια κλειστή αλυσίδα άνθρακα, με τριπλούς δεσμούς και ο γενικός τύπος της είναι CόχιΗ2όχι-4.
Αρωματικός

ή

Επίσης λέγεται αρένες, οι αρωματικοί υδρογονάνθρακες είναι ακόρεστες ενώσεις που σχηματίζονται από διπλούς δεσμούς.
Ένα αρωματικό έχει κλειστή ή κυκλική αλυσίδα άνθρακα και ο γενικός τύπος του είναι C6Η6.
Τύπος συγκόλλησης αλυσίδων άνθρακα
Ανάλογα με τον τύπο σύνδεσης των ανθρακικών αλυσίδων, οι υδρογονάνθρακες μπορούν να ταξινομηθούν σε κορεσμένο ή ακόρεστα.
Δείτε παρακάτω τι αποτελείται από κάθε μία από αυτές τις κατηγοριοποιήσεις
Κορεσμένοι υδρογονάνθρακες
Οι κορεσμένοι υδρογονάνθρακες σχηματίζονται από απλοί σύνδεσμοι.
Παραδείγματα: αλκάνια, κυκλάνοι.
ακόρεστοι υδρογονάνθρακες
Οι ακόρεστοι υδρογονάνθρακες σχηματίζονται από διπλοί δεσμοί ή τριπλάσια.
Παραδείγματα: αλκένια, αλκύνια, αλκαδιένια.
Παρουσία αλκυλ ριζών
Όσον αφορά την παρουσία αλκυλ ριζών, οι υδρογονάνθρακες μπορούν να έχουν αλυσίδα άνθρακα κανονικός ή κλαδωτός.
κανονική αλυσίδα άνθρακα
Ένας φυσιολογικός υδρογονάνθρακας αλυσίδας άνθρακα δεν έχει ρίζες αλκυλίου.
Παράδειγμα: πεντάνιο
διακλαδισμένη ανθρακική αλυσίδα
Όταν ένας υδρογονάνθρακας έχει διακλαδισμένη αλυσίδα άνθρακα, αυτό σημαίνει ότι η κύρια αλυσίδα άνθρακα έχει ρίζες αλκυλίου.
Παράδειγμα: μεθυλοπροπάνιο
Παρουσία ετεροάτομων που διαιρούν την ανθρακική αλυσίδα
Η διαδοχική αλυσίδα άνθρακα μπορεί ή όχι να χωρίζεται ανάλογα με την παρουσία ετεροάτομων.
Ομοιογενής αλυσίδα άνθρακα
Όταν ένας υδρογονάνθρακας έχει μια ομοιογενή κύρια αλυσίδα άνθρακα, αυτό σημαίνει ότι αυτή η αλυσίδα δεν είναι διαιρεμένο από ετεροάτομα.
Ετερογενής αλυσίδα άνθρακα
Εάν ένας υδρογονάνθρακας έχει ετερογενή κύρια αλυσίδα άνθρακα, αυτή η αλυσίδα είχε διαχωρισμένη αλυσίδα άνθρακα από ετεροάτομο.
Ονοματολογία υδρογονανθράκων
Η ονοματολογία των υδρογονανθράκων ορίζεται μέσω ενός συνδυασμού τριών μερών:

Το πρόθεμα προσδιορίζει την ποσότητα των ανθράκων, το ενδιάμεσο προσδιορίζει τον τύπο του δεσμού και το επίθημα υποδεικνύει τη λειτουργία στην οποία ανήκει η ένωση (στην περίπτωση αυτή, η κατηγορία των υδρογονανθράκων).
Δείτε παρακάτω για τη λίστα των προθεμάτων και των ενδιάμεσων που συνδυάζονται για τον προσδιορισμό υδρογονανθράκων.
Λίστα προθεμάτων
| Αριθμός άνθρακα | Πρόθεμα |
|---|---|
| 1 | Συνάντησε- |
| 2 | Κ.λπ. |
| 3 | Στήριγμα- |
| 4 | Αλλά- |
| 5 | έγκλειστος- |
| 6 | Μαγεύω- |
| 7 | Επτά- |
| 8 | Οκτ- |
| 9 | Μη- |
| 10 | Δεκ- |
Λίστα μεσολαβητών
| Τύπος σύνδεσης | Μεσολαβητής |
|---|---|
| Μόνο μεμονωμένες κλήσεις | -ένα- |
| Ζεύγος | -εν- |
| τριπλούς | -σε- |
| δύο ζευγάρια | -αδέν- |
Δείτε μερικά παραδείγματα ονομασίας υδρογονανθράκων.
Παραδείγματα:
Χ.Χ.3 - CH2 - CH2 - CH3
Στην παραπάνω δομική μορφή, μπορούμε να δούμε μια ένωση 4-άνθρακα που έχει μόνο μεμονωμένους δεσμούς (υποδεικνύεται από το σύμβολο "-").
- Πρόθεμα για 4 άνθρακες = αλλά-
- Ενδιάμεσο για μονή δέσμευση = -an-
- Επίθημα υδρογονάνθρακα = -o
Δείτε ότι η ένωση της πρόθεμα + ενδιάμεσο + επίθημα δημιουργεί το όνομα ΒΟΥΤΑΝΙΟ.
Χ.Χ.2 = ΧΗ2
Η παραπάνω δομική μορφή έχει 2 άνθρακες και 1 διπλό δεσμό (υποδεικνύεται από το σύμβολο "=").
- Πρόθεμα για 2 άνθρακες = et-
- Ενδιάμεσο για διπλούς δεσμούς = -en-
- Επίθημα υδρογονάνθρακα = -o
Δείτε ότι η ένωση της πρόθεμα + ενδιάμεσο + επίθημα δημιουργεί το όνομα ΑΘΗΝΑ.
Χ.Χ.2 = CH - CH2 - CH3
Χ.Χ.3 - CH = CH2 - CH3
Σημειώστε ότι και οι δύο παραπάνω δομικές μορφές έχουν 4 άνθρακες και 1 διπλό δεσμό (υποδεικνύεται από το σύμβολο "=").
Έτσι, έχουμε:
- Πρόθεμα για 4 άνθρακες = αλλά-
- Ενδιάμεσο για διπλούς δεσμούς = -en-
- Επίθημα υδρογονάνθρακα = -o
Δείτε ότι η ένωση της πρόθεμα + ενδιάμεσο + επίθημα θα έδινε το όνομα BUTENE για τις δύο δομικές μορφές.
Ωστόσο, σημειώστε ότι οι δομικές μορφές δεν είναι πανομοιότυπες, επομένως οι ονοματολογίες δεν μπορούν να είναι ούτε αυτές.
Η διαφορά μεταξύ των δύο δομικών μορφών έγκειται στη θέση του διπλού δεσμού.
Σε αυτήν την περίπτωση, πρέπει να αριθμήσουμε τους άνθρακες στην αλυσίδα από το άκρο που βρίσκεται πλησιέστερα στο διπλό. Επομένως, στις εν λόγω περιπτώσεις, πρέπει να αριθμούμε από αριστερά προς τα δεξιά.
Σε Χ.Χ.2 = CH - CH2 - CH3:
- Χ.Χ.2 θα είναι το 1
- Το CH θα είναι το 2
- Χ.Χ.2 θα είναι το 3
- Χ.Χ.3 θα είναι το 4
Σημειώστε ότι το διπλός δεσμός είναι μεταξύ του άνθρακας 1 είναι το άνθρακας 2.
Πρέπει να χρησιμοποιήσουμε τον μικρότερο αριθμό (1) για να βρούμε τον διπλό δεσμό: BUTENE -1
Σε Χ.Χ.3 - CH = CH2 - CH3:
- Χ.Χ.3 θα είναι το 1
- Το CH θα είναι το 2
- Χ.Χ.2 θα είναι το 3
- Χ.Χ.3 θα είναι το 4
Σημειώστε ότι ο διπλός δεσμός βρίσκεται μεταξύ του άνθρακας 2 είναι το άνθρακας 3.
Πρέπει να χρησιμοποιήσουμε τον μικρότερο αριθμό (2) για να βρούμε τον διπλό δεσμό: BUTENE -2
Σύμφωνα με IUPAC (Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας - International Union of Pure and Applied Chemistry), η τοποθεσία θα πρέπει να αναφέρεται λίγο πριν από το να βρίσκεται (στην περίπτωση των παραπάνω δομικών τύπων, ο διπλός δεσμός, που αντιπροσωπεύεται από το ενδιάμεσο "-En-").
Με αυτό, έχουμε έναν δεύτερο τρόπο, ο οποίος παρεμπιπτόντως είναι ο πιο σωστός, να γράφουμε την ονοματολογία των διαθέσιμων δομικών μορφών.
Χ.Χ.2 = CH - CH2 - CH3: BUTENE -1 ή BUT-1-ENO (πιο σωστή φόρμα)
Χ.Χ.3 - CH = CH2 - CH3: BUTENE -2 ή BUT-2-ENE (πιο σωστή μορφή)
Μάθε περισσότερα για IUPAC και ονοματολογία.


