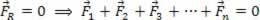Ο νόμος του Dalton δηλώνει ότι η μερική πίεση κάθε αερίου σε ένα μείγμα αερίων είναι ίση με την πίεση που θα ασκούσε καταλαμβάνοντας τον όγκο του μείγματος, στην ίδια θερμοκρασία. Επομένως, η συνολική πίεση του μείγματος αερίου είναι το άθροισμα των μερικών πιέσεων κάθε αερίου που το συνθέτει.
Ας εξετάσουμε δύο τύπους αερίων, Α και Β. Καθένα από αυτά καταλαμβάνει τον ίδιο όγκο V και έχει την ίδια θερμοκρασία T. Εάν εφαρμόσουμε την εξίσωση Clapeyron στα δύο αέρια Α και Β, έχουμε:
ΠΟ .V = νΟ .R .T και σελσι .V = νσι .R .T
Όπως φαίνεται στο παραπάνω σχήμα, εάν αναμειγνύουμε τα δύο αέρια, τον αριθμό γραμμομορίων των αερίων στο μείγμα (όχιΜ) γινεται:
όχιΜ= νΟ+ νσι
Οπου:

Αλλά nm = (Pm.V) / R. Τ; οπότε έχουμε:

Κάνοντας μερικές απλοποιήσεις στην παραπάνω έκφραση, έχουμε:
ΠΜ= σΟ+ σελσι (Ο νόμος του Ντάλτον)
Μπορούμε να εφαρμόσουμε τον ίδιο συλλογισμό σε αέρια διαφορετικών όγκων και θερμοκρασιών. Ας δούμε το παρακάτω σχήμα, στο οποίο δύο μπαλόνια που συνδέονται με ένα σωλήνα αμελητέου όγκου έχουν μια βρύση επαφής. Αυτά τα μπαλόνια έχουν δύο αέρια Α και Β, με θερμοκρασίες και όγκους διαφορετικούς μεταξύ τους. Από το σχήμα βλέπουμε ότι η βρύση είναι κλειστή, επομένως:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
ΠΟ .V = νΟ .R .T και σελσι .V = νσι .R .T

Αργότερα, εάν ανοίξουμε τη βρύση, θα δούμε ότι τα αέρια αναμιγνύονται, όπως φαίνεται στην παρακάτω εικόνα:

Για αυτό το μείγμα, έχουμε τις ακόλουθες σχέσεις:
ΒΜ= VΟ+ V.σι
ΠΟ .V = νΟ .R .T
Πσι .V = νσι .R .T
Έχουμε λοιπόν ότι η τελική σχέση αυτού του μείγματος μπορεί να επεκταθεί σε ένα μείγμα όχι αέρια. Ετσι:


Από τον Domitiano Marques
Αποφοίτησε στη Φυσική
Σχολική ομάδα της Βραζιλίας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
SILVA, Domitiano Correa Marques da. "Μείγμα αερίων" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/fisica/mistura-gasosa.htm. Πρόσβαση στις 27 Ιουνίου 2021.