Κάθε κελί είναι μια συσκευή στην οποία εμφανίζεται μια αυτόματη αντίδραση μείωσης της οξείδωσης που δημιουργεί ένα ηλεκτρικό ρεύμα, το οποίο, με τη σειρά του, χρησιμοποιείται για να λειτουργήσει κάποιος εξοπλισμός.
Αυτές οι συσκευές πήραν το όνομά τους επειδή η πρώτη μπαταρία που δημιουργήθηκε εφευρέθηκε από τον Alessandro Το έτος 1800, σχηματίστηκε από δίσκους ψευδαργύρου και χαλκού που χωρίζονται με βαμβάκι εμποτισμένο άλμη. Αυτό το σετ τοποθετήθηκε διάσπαρτα, το ένα πάνω από το άλλο, συσσωρεύονται οι δίσκοι και σχηματίζουν μια μεγάλη στήλη. Πώς ήταν ένα μπαταρία δίσκων, άρχισαν να ονομάζονται με αυτό το όνομα.

Οι μπαταρίες αποτελούνται πάντα από δύο ηλεκτρόδια και έναν ηλεκτρολύτη. Το θετικό ηλεκτρόδιο ονομάζεται a κάθοδος και εδώ είναι η αντίδραση του μείωση. Το αρνητικό ηλεκτρόδιο είναι το άνοδος και εδώ είναι η αντίδραση του οξείδωση. Ο ηλεκτρολύτης ονομάζεται επίσης γέφυρα αλατιού και είναι η ιοντοαγωγική λύση.
Για να καταλάβετε πώς παράγει ηλεκτρικό ρεύμα, δείτε την περίπτωση μιας από τις πρώτες μπαταρίες, το
Ο σωρός του Ντάνιελ, στο οποίο υπήρχε ένα δοχείο με διάλυμα θειικού χαλκού (CuSO4 (υδ)) και, βυθισμένο σε αυτό το διάλυμα, ήταν μια χαλκού πλάκα. Σε ένα άλλο ξεχωριστό δοχείο, υπήρχε ένα διάλυμα θειικού ψευδαργύρου (ZnSO4 (υδ)) και μια βυθισμένη πλάκα ψευδαργύρου. Τα δύο διαλύματα συνδέθηκαν με γέφυρα αλατιού, η οποία ήταν γυάλινος σωλήνας με διάλυμα θειικού καλίου (Κ2ΜΟΝΟ4 (υδ)) με γυάλινο μαλλί στα άκρα. Τέλος, οι δύο πλάκες διασυνδέθηκαν από ένα εξωτερικό κύκλωμα, με μια λάμπα, του οποίου ο φωτισμός υποδεικνύει τη διέλευση του ηλεκτρικού ρεύματος: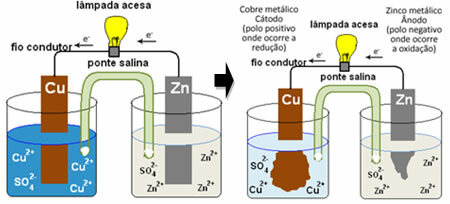
Αυτό που συμβαίνει είναι ότι ο ψευδάργυρος έχει μεγαλύτερη τάση να οξειδώνεται, δηλαδή, να χάσει ηλεκτρόνια, οπότε ο μεταλλικός ψευδάργυρος της λεπίδας λειτουργεί ως το αρνητικό ηλεκτρόδιο, η άνοδος, όπου συμβαίνει οξείδωση: Ζν(α) ↔ Zn2+(εδώ) +2 και-. Τα ηλεκτρόνια που χάνονται από τον ψευδάργυρο μεταφέρονται από το εξωτερικό κύκλωμα στον χαλκό, δημιουργώντας το ηλεκτρικό ρεύμα που ανάβει τη λάμπα. Τα ιόντα χαλκού στο διάλυμα δέχονται ηλεκτρόνια (μείωση) και μετατρέπονται σε μεταλλικό χαλκό που εναποτίθεται στο φύλλο χαλκού. Αυτό σημαίνει ότι αυτό είναι το θετικό ηλεκτρόδιο, κάθοδος, όπου συμβαίνει η μείωση: Γάιδαρος2+(εδώ) +2 και- ↔ κώλο(ες).
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Οι σημερινές μπαταρίες έχουν την ίδια αρχή λειτουργίας, στην οποία ένα μέταλλο δίνει ηλεκτρόνια σε άλλο, μέσω αγώγιμης λύσης και παράγεται ηλεκτρικό ρεύμα. Η διαφορά είναι ότι οι μπαταρίες που χρησιμοποιούνται σήμερα είναι στεγνές, επειδή δεν χρησιμοποιούν υγρό διάλυμα ως ηλεκτρολύτη, όπως συμβαίνει στην μπαταρία της Daniell.
Σήμερα υπάρχει μια πολύ μεγάλη ποικιλία μπαταριών που πωλούνται στο εμπόριο. Μεταξύ αυτών τα πιο συνηθισμένα είναι τα όξινα κύτταρα (από Leclanché) και τοαλκαλικές μπαταρίες.
Και τα δύο έχουν ψευδάργυρο ως αρνητικό ηλεκτρόδιο. από την άλλη πλευρά, ως θετικός πόλος, υπάρχει μια ράβδος γραφίτη εγκατεστημένη στη μέση του σωρού που περιβάλλεται από διοξείδιο του μαγγανίου (MnO2), άνθρακας σε σκόνη (C) και υγρή πάστα. Η διαφορά είναι ότι, στο σωρό οξέος, χρησιμοποιείται χλωριούχο αμμώνιο (ΝΗ) στην υγρή πάστα.4Cl) και χλωριούχο ψευδάργυρο (ZnCl2) - όξινα άλατα - εκτός από το νερό (H2Ο). Στην αλκαλική μπαταρία, χρησιμοποιείται υδροξείδιο του καλίου (KOH), το οποίο είναι μια βάση.

Οι μπαταρίες Leclanché ταιριάζουν καλύτερα σε εξοπλισμό που απαιτεί ελαφριά και συνεχή εκφόρτιση, όπως τηλεχειριστήριο, ρολόι τοίχου, φορητό ραδιόφωνο και παιχνίδια. Οι αλκαλικές μπαταρίες, από την άλλη πλευρά, έχουν 50 έως 100% περισσότερη ενέργεια από μια συνηθισμένη μπαταρία του ίδιου μεγέθους, συνιστάται για εξοπλισμό που απαιτούν γρηγορότερες και πιο έντονες λήψεις, όπως ραδιόφωνα, συσκευές αναπαραγωγής CD / DVD, φορητές συσκευές MP3, φακούς, ψηφιακές φωτογραφικές μηχανές και τα λοιπά.

Μάθετε περισσότερα για το ποιοι ηλεκτρολύτες και ηλεκτρόδια χρησιμοποιούνται σε αυτούς και σε άλλους τύπους μπαταριών. Όσον αφορά τους τύπους εξοπλισμού που συνιστώνται περισσότερο, διαβάζοντας τα σχετικά άρθρα περισσότερο βελάζω.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
