Ογκομετρική ανάλυση ή ογκομετρία είναι ένα εργαστηριακή διαδικασία στην οποία χρησιμοποιούμε έναν συγκεκριμένο όγκο α λύση σε συγκέντρωση είναι γνωστό ότι προσδιορίζει τη συγκέντρωση ενός άλλου διαλύματος. Ο όγκος του διαλύματος της γνωστής συγκέντρωσης θα προσδιοριστεί όταν αντιδρά πλήρως με το διάλυμα της άγνωστης συγκέντρωσης, δηλαδή, τα εν λόγω διαλύματα πρέπει να αντιδρούν μεταξύ τους.
Τα όργανα που χρησιμοποιούνται περισσότερο για τη μέτρηση ενός δεδομένου όγκου είναι:
- Σταγονόμετρο

Παράδειγμα πιπέτας που χρησιμοποιείται στη μέτρηση όγκου
- Μπουρέτα

Η προχοΐδα είναι ένας σημαντικός ογκομετρικός εξοπλισμός μέτρησης
Η μέτρηση του όγκου γίνεται με την αξιολόγηση του ύψους του λεγόμενου μηνίσκου, η οποία δεν είναι τίποτα περισσότερο από την επιφανειακή περιοχή του υγρού, η οποία παρουσιάζει μια ορθογώνια ή θολωτή όψη (σχήμα πτώσης), ανάλογα με το πάχος του δοχείου. Όσο ευρύτερο είναι το δοχείο, τόσο πιο ορθογώνιος είναι ο μηνίσκος. Όσο πιο λεπτό είναι το δοχείο, τόσο πιο κυρτό θα είναι. Για την εκτίμηση του μηνίσκου, το μάτι πρέπει να βρίσκεται ακριβώς στο ύψος του και πρέπει να χρησιμοποιήσουμε την κάτω περιοχή ως σημείο αναφοράς, εάν ο μηνίσκος είναι ορθογώνιος ή το άκρο, εάν είναι διογκωμένο. Δείτε μια αναπαράσταση μιας αξιολόγησης:
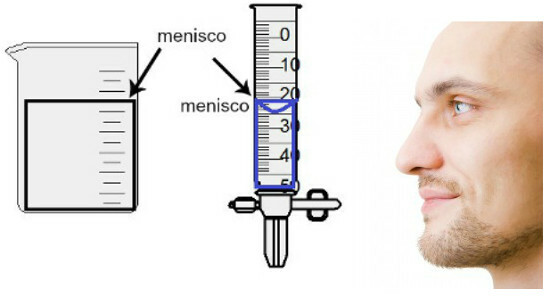
Για να αξιολογήσετε έναν μηνίσκο, είναι σημαντικό τα μάτια σας να το κοιτάζουν.
Στην ογκομετρική ανάλυση, ο πιο χρησιμοποιημένος εξοπλισμός είναι η προχοΐδα. Αυτό συμβαίνει επειδή, επειδή η μέθοδος περιλαμβάνει χημικές αντιδράσεις και αυτές μπορούν να υποστούν επεξεργασία γρήγορα, το επιτρέπει η προχοΐδα το υγρό απελευθερώνεται στην άκρη του σε σταγόνες, γεγονός που μας επιτρέπει να σταματήσουμε να βγαίνει περισσότερο ελεγχόμενη.
Μία από τις πιο χρησιμοποιούμενες διαδικασίες στο ογκομετρία είναι η ογκομετρική ανάλυση. Είναι μια ογκομετρική ανάλυση που περιλαμβάνει την εμφάνιση μιας αντίδρασης μεταξύ ενός οξέος και μιας βάσης ή αντιστρόφως. Ο απαραίτητος εξοπλισμός για την υλοποίησή του παρουσιάζεται στην παρακάτω εικόνα:
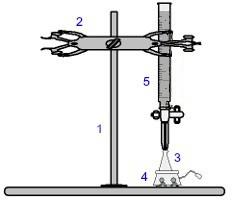
Αναπαράσταση του εξοπλισμού που χρησιμοποιείται σε τιτλοδότηση
Οι αριθμοί με μπλε σημαίνει:
1) Καθολική υποστήριξη;
2) Νύχι (χρησιμοποιείται για να κρατήσει την προχοΐδα).
3) Erlenmeyer (λαμβάνει τη λύση της άγνωστης συγκέντρωσης).
4) Μαγνητικός αναδευτήρας (χρησιμοποιείται για την ανάδευση του διαλύματος που υπάρχει στη φιάλη Erlenmeyer).
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
5) Burette (λαμβάνει τη λύση της γνωστής συγκέντρωσης).
Ένας όγκος διαλύματος άγνωστης συγκέντρωσης με τον δείκτη φαινολφθαλεΐνης προστίθεται στη φιάλη erlenmeyer (αμέσως το διάλυμα θα γίνει ροζ). Στην προχοΐδα, τοποθετείται ένας ορισμένος όγκος του διαλύματος γνωστής συγκέντρωσης. Στη συνέχεια, το όξινο διάλυμα από την προχοΐδα στάζει κατευθείαν στο βασικό διάλυμα στη φιάλη Erlenmeyer. Αυτή η στάγδην διαρκεί έως ότου το διάλυμα βάσης γίνει άχρωμο, σε αυτό το σημείο καλούμε το σημείο καμπής, το οποίο δείχνει ότι όλη η βάση που υπάρχει στο διάλυμα έχει αντιδράσει πλήρως με το οξύ.
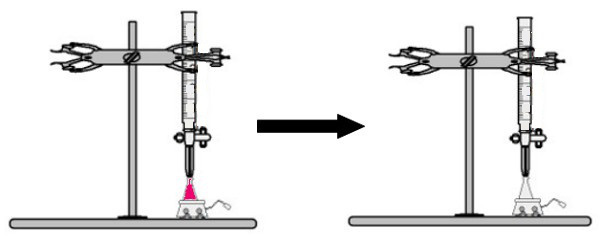
Στο σημείο καμπής, το διάλυμα δεν είναι πλέον ροζ και γίνεται άχρωμο
Παρατήρηση: Εάν το διάλυμα άγνωστης συγκέντρωσης είναι οξύ, όταν λαμβάνει τον δείκτη φαινολοφθαλεΐνης, θα είναι άχρωμο. Έτσι, το σημείο καμπής της τιτλοδότησης θα είναι όταν το όξινο διάλυμα γίνεται ροζ όταν λαμβάνεται το βασικό διάλυμα από την προχοΐδα.
Τέλος, για να προσδιορίσετε τη συγκέντρωση της βασικής λύσης, απλώς χρησιμοποιήστε την ακόλουθη εξίσωση:
Ma.Va = Mb.Vb
Ma = οξύτητα οξέος;
Va = όγκος οξέος;
Mb = μεταβλητότητα βάσης;
Vb = βασικός όγκος.
Τώρα ακολουθήστε ένα παράδειγμα του τρόπου με τον οποίο γίνεται ο υπολογισμός μιας λύσης με άγνωστη μοριακότητα.
1ο) 30 mL άγνωστου διαλύματος βάσης προστέθηκαν σε μια φιάλη Erlenmeyer για να εκτελεστεί μια τιτλοδότηση για να προσδιοριστεί η συγκέντρωσή της (μοριακότητα). Στην προχοΐδα προστέθηκαν 50 ml ενός όξινου διαλύματος με συγκέντρωση 0,2 mol / L. Μετά από πτώση του διαλύματος οξέος και μέχρις ότου το βασικό διάλυμα τιτλοδοτήθηκε, παρατηρήθηκε ότι 20 ml του όξινου διαλύματος χρησιμοποιήθηκαν στην τιτλοδότηση. Προσδιορίστε τη μοριακότητα του διαλύματος βάσης που χρησιμοποιείται.
Δεδομένα άσκησης:
Vb = 30 mL
Mb =?
Ma = 0,2 mol / L
Va = 20 mL
Καθώς η μοριακότητα του οξέος και ο όγκος του είναι, αντίστοιχα, 0,2 mol / L και 20 mL, και ο όγκος της βάσης που χρησιμοποιείται είναι 30 mL, απλώς χρησιμοποιήστε τον τύπο τιτλοδότησης:
Ma.Va = Mb.Vb
0,2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / L
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Ογκομετρική ανάλυση ή ογκομετρία" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm. Πρόσβαση στις 28 Ιουνίου 2021.