* Θεωρία του Αρχενίου:
Με βάση τα πειράματά του με την ηλεκτρική αγωγιμότητα σε υδατικά μέσα, τη χημική, φυσική και μαθηματική Ο Σουηδός Svante August Arrhenius (1859-1927) πρότεινε, το 1884, τις ακόλουθες έννοιες για τον ορισμό οξέων και βάσεις:

Έτσι, γενικά, έχουμε:
Η+ + Χ2O → Η3Ο+
Παραδείγματα:
HCl + Η2O → Η3Ο++ Cl-
HNO3+ Χ2O → Η3Ο+ + ΟΧΙ3-
Η2ΜΟΝΟ4+ 2Η2O → 2Η3Ο+ + Λειτουργικό σύστημα42-

Παραδείγματα:
NaOH → Να + + Ω-
Ca (ΟΗ)2 → Γα2+ + 2 Ω-
* Θεωρία Brönsted-Lowry:
Ανεξάρτητα, ο Δανός Johannes Nicolaus Brönsted (1879-1947) και ο Άγγλος Thomas Martin Lowry (1874-1936), πρότεινε τον ίδιο χρόνο μια άλλη θεωρία οξέος-βάσης γνωστή ως η θεωρία Brönsted-Lowry, η οποία λέει ότι ΕΠΟΜΕΝΟ:

Στην περίπτωση αυτή, το ιόν υδρογόνου θεωρείται πρωτόνιο. Αυτό φαίνεται στην ακόλουθη αντίδραση, όπου το υδροκυανικό οξύ δίνει ένα πρωτόνιο στο νερό, το οποίο ως εκ τούτου δρα ως βάση:
HCN + Η2O → CN- + Χ3Ο+
Αυτή η αντίδραση είναι αναστρέψιμη, με το ιόν υδρονίου (Η3Ο+) μπορεί να δωρίσει ένα πρωτόνιο στο ιόν CN-. Έτσι, το ιόν υδρονίου (Η3Ο+) λειτουργεί ως οξύ και το CN- ως βάση.
ΣΟ- + Χ3Ο+→ HCN + H2Ο
* Θεωρία Lewis:
Αυτή η θεωρία δημιουργήθηκε από τον Αμερικανό χημικό Gilbert Newton Lewis (1875-1946) και λέει τα εξής:

Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Αυτή η θεωρία εισάγει μια νέα αντίληψη, είναι πιο περιεκτική, αλλά δεν ακυρώνει τη θεωρία Brönsted-Lowry. Για κάθε οξύ Lewis είναι ένα οξύ Brönsted, και επομένως κάθε βάση του Lewis είναι μια βάση Brönsted. Αυτό συμβαίνει επειδή ένα πρωτόνιο δέχεται ηλεκτρόνια, που σημαίνει ότι ένα οξύ Lewis μπορεί να ενώσει ένα μοναχικό ζεύγος ηλεκτρονίων σε μια βάση Lewis.
Για τον Lewis, μια αντίδραση οξέος-βάσης συνίσταται στον σχηματισμό ενός πιο σταθερού συντονισμένου ομοιοπολικού δεσμού. Έτσι, όταν μια βάση Lewis δωρίζει ένα ζευγάρι ηλεκτρονίων σε μια βάση Lewis, και οι δύο σχηματίζουν ένα συντεταγμένος ομοιοπολικός δεσμός, στον οποίο και τα δύο ηλεκτρόνια προέρχονται από ένα από τα άτομα, όπως στο παράδειγμα βελάζω:
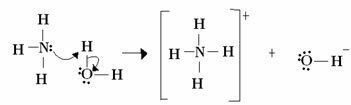
Σε αυτήν την περίπτωση, η αμμωνία δρα ως βάση Lewis και Brönsted, καθώς δωρίζει τα δύο ηλεκτρόνια της στο πρωτόνιο και ως εκ τούτου είναι ο δέκτης του πρωτονίου. Επιπλέον, σχηματίστηκε ένας ομοιοπολικός δεσμός μεταξύ υδρογόνου (πρωτονίου) και αμμωνίας.
Το νερό είναι οξύ Lewis και οξύ Brönsted, καθώς δωρίζει το πρωτόνιο και δέχεται ηλεκτρόνια, παρατηρήστε πώς το οξυγόνο στο υδροξείδιο που σχηματίζεται από το νερό έχει ένα επιπλέον ζεύγος ηλεκτρονίων.

Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Σχολική ομάδα της Βραζιλίας.
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Θεωρίες βάσης οξέος Arrhenius, Brönsted-Lowry και Lewis". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. Πρόσβαση στις 28 Ιουνίου 2021.
