Υπάρχουν τρεις τύποι αλκαδιενίων ή διένων, οι οποίοι είναι:
1-Συσσώρευση: Οι διπλοί δεσμοί βρίσκονται στον ίδιο άνθρακα και εμφανίζονται διαδοχικά:
─ Γ ═ ΝΤΟ ═ Γ ─
│ │
2- Απομονωμένο: Οι διπλοί δεσμοί είναι σε διαφορετικούς άνθρακες και διαχωρίζονται από τουλάχιστον δύο διαδοχικούς μεμονωμένους δεσμούς:
│
─ Γ ═ Γ C ─ Γ ═ Γ ─
│ │ │ │ │
3- Συζεύγματα: Οι διπλοί δεσμοί εμφανίζονται εναλλάξ, χωρίζοντάς τους με έναν μόνο δεσμό
─ Γ ═ Γ Γ ═ Γ ─
│ │ │ │
Ένα παράδειγμα σημαντικού συζευγμένου διενίου είναι το ισοπρένιο, το οποίο είναι μια βασική μονάδα της ομάδας τερπενίου, μια κατηγορία οργανικών ενώσεων. πολύ σημαντικό, μερικά παραδείγματα προϊόντων που σχηματίζονται από ισοπρένια είναι το καουτσούκ, το β-καροτένιο (υπεύθυνο για το πορτοκαλί χρώμα του καρότα), βιταμίνη Α και έλαια που βρίσκονται σε φλούδες φρούτων, σπόρους, άνθη, φύλλα, ρίζες, λαχανικά και ξύλο, όπως λιμονένιο και μυκήνιο.
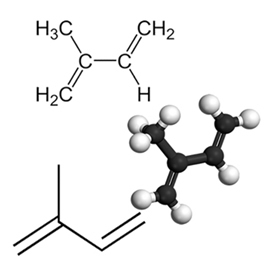
Στο συσσωρευμένες και απομονωμένες διένιες, εμφανίζονται αντιδράσεις προσθήκης όπως στην περίπτωση των αλκενίων
, τι μπορείτε να καταλάβετε διαβάζοντας το κείμενο Αντιδράσεις προσθήκης. Η μόνη διαφορά είναι ότι τα διένια υφίστανται αυτόν τον τύπο διπλής αντίδρασης, επειδή έχουν δύο διπλούς δεσμούς, ενώ τα αλκένια έχουν μόνο έναν διπλό δεσμό.Ωστόσο, στην περίπτωση του συζευγμένα διένια, η αντίδραση προσθήκης έχει μια ιδιαιτερότητα, καθώς αυτές οι ενώσεις μπορούν να υποστούν συντονισμό, οπότε η προσθήκη μπορεί να πραγματοποιηθεί με δύο τρόπους:
1- Προσθήκη 1.2:
Αυτό θεωρείται κανονική προσθήκη, καθώς η προσθήκη εμφανίζεται στα δύο άτομα άνθρακα που κάνουν τον ίδιο διπλό δεσμό, δηλαδή στους άνθρακες 1 και 2:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Η2ΝΤΟ ═ CH─ CH ═ Χ.Χ.2 + HBr → Η2Γ CH─ CH ═ Χ.Χ.2
│ │
HBr
Δείτε ότι αυτός ο τύπος αντίδρασης ακολουθεί το Ο κανόνας του Μάρκοβνικοφ, το υδρογόνο συνδέεται με τον περισσότερο υδρογονωμένο άνθρακα (με συνδεδεμένα περισσότερα άτομα υδρογόνου).
Η προσθήκη 1,2 υποβάλλεται σε επεξεργασία σε χαμηλές θερμοκρασίες (-60 ° C).
2- Προσθήκη 1.4:
Σε αυτήν την περίπτωση, η αντίδραση προχωρά σε υψηλές θερμοκρασίες. Είναι σημαντικό να τονιστεί ότι τόσο το προϊόν της προσθήκης 1.2 όσο και η προσθήκη 1.4 είναι πάντα διαμορφωμένα, αλλά η θερμοκρασία υποδεικνύει ποια θα σχηματιστεί σε μεγαλύτερη ποσότητα.
Το παρακάτω είναι ένα παράδειγμα προσθήκης τύπου 1.4:
Η2ΝΤΟ ═ CH─ CH ═ Χ.Χ.2 + HBr → Η2Γ CH ═ CH─CH2
│ │
HBr
Σημειώστε ότι συμβαίνουν τα ακόλουθα, ένα από τα κοινόχρηστα ηλεκτρόνια στον δεσμό pi καθενός από τους διπλούς άνθρακες μοιράζονται με τον υποκαταστάτη και οι άλλοι σχηματίζουν έναν νέο διπλό δεσμό μεταξύ άλλων ανθράκων:
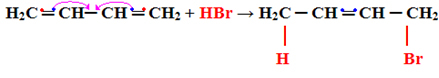
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Αντιδράσεις προσθήκης στο Dienes"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm. Πρόσβαση στις 28 Ιουνίου 2021.


