Εάν αναλύσουμε την ηλεκτρονική κατανομή ενός δεδομένου ατόμου στο ενεργειακό διάγραμμα (ή διάγραμμα του Pauling) είναι δυνατό να «προβλέψουμε» δύο ερωτήσεις σχετικά με τη θέση του στοιχείου αυτού του ατόμου στον Πίνακα Περιοδικός: την περίοδο και την οικογένεια.
Ας εξετάσουμε πρώτα την περίοδο:

Για παράδειγμα, εξετάστε την περίπτωση τεσσάρων στοιχείων από διαφορετικές περιόδους:
·Be (Z = 4): Α γεωμετρική σειρά της ηλεκτρονικής διανομής του βηρυλλίου είναι: 1s2 / 2μικρό2.
Δείτε ότι έχουν συμπληρωθεί 2 επίπεδα, έτσι το βηρύλλιο είναι από το 2º πορεία χρόνου.
·Na (Z = 11): Η γεωμετρική σειρά της ηλεκτρονικής διανομής νατρίου είναι: 1s2 / 2 δευτ2 2ρ6 / 3μικρό1.
Σε αυτήν την περίπτωση, γεμίστηκαν 3 επίπεδα, οπότε το νάτριο προέρχεται από το 3º πορεία χρόνου.
·Ως (Z = 33): Η γεωμετρική σειρά της ηλεκτρονικής κατανομής του αρσενικού είναι: 1s2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 3δ10 / 4 δευτ24Π3.
Γεμίστηκαν 4 επίπεδα, οπότε το αρσενικό προέρχεται από το 4º πορεία χρόνου.
·I (Z = 53): Η γεωμετρική σειρά της ηλεκτρονικής κατανομής του ιωδίου είναι: 1s
2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 3δ10 / 4 δευτ2 4ρ6 4δ10 / 5 δευτ25Π5.Γεμίστηκαν 5 επίπεδα, έτσι το ιώδιο προέρχεται από το 5º πορεία χρόνου.
Τώρα ας εξετάσουμε πώς μπορούμε να ανακαλύψουμε την οικογένεια στοιχείων:

Δείτε πώς συμβαίνει αυτό σε καθεμία από τις ομάδες στοιχείων που αναφέρονται παραπάνω:
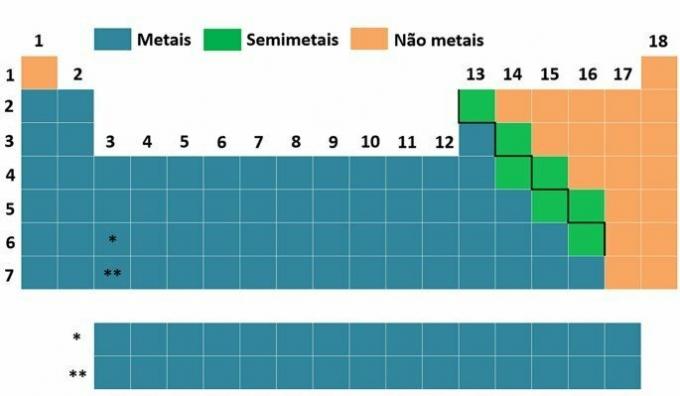
·Αντιπροσωπευτικά στοιχεία:
Αυτά τα στοιχεία είναι εκείνα που ανήκουν στις οικογένειες: 1, 2, 13, 14, 15, 16, 17 και 18. Ονομάζονται επίσης τυπικά ή χαρακτηριστικά στοιχεία και στους πίνακες που δεν έχουν ενημερωθεί αντιστοιχούν στα στοιχεία που βρίσκονται στις στήλες Α (IA, IIA, IIIA, IVA, VA, VIA, VIIA, VIII A).
Κάθε φορά που το πιο ενεργητικό ηλεκτρόνιο βρίσκεται σε δευτερεύον επίπεδο s ή p, θα είναι ένα αντιπροσωπευτικό στοιχείο. Επιπλέον, το άθροισμα των ηλεκτρονίων που έχουν συμπληρωθεί στο εξώτατο επίπεδο μας δείχνει ποια είναι η αντίστοιχη οικογένειά τους.
Δείτε πώς συμβαίνει αυτό:
·Οικογένεια 1: Όλα έχουν 1 ηλεκτρόνιο στο τελευταίο επίπεδο ενέργειας.
Παραδείγματα:
1Η: 1δ1 → Παρά το γεγονός ότι δεν είναι αλκαλικό μέταλλο, το υδρογόνο εμφανίζεται στον πίνακα της οικογένειας 1 επειδή έχει 1 ηλεκτρόνιο στο τελευταίο και μόνο κέλυφος του.
3Διάβασα: 1s2 / 2 δευτ1
11Σε: 1s2 / 2 δευτ2 2ρ6 / 3 δευτ1
19Κ: 1δ2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 / 4 δευτ1
37Rb: 1δ2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 3δ10 / 4 δευτ2 4ρ6 / 5 δευτ1
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
55Cs: 1s2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 3δ10 / 4 δευτ2 4ρ6 4δ10 / 5 δευτ2 5ρ6 / 6 δευτ1
87Παρ: 1δ2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 3δ10 / 4 δευτ2 4ρ6 4δ10 4στ14 / 5 δευτ2 5ρ6 5δ10 / 6 δευτ2 6ρ6 / 7 δευτ1
Έτσι, μπορούμε να συμπεράνουμε ότι η ηλεκτρονική διαμόρφωση των στοιχείων αυτής της ομάδας τελειώνει μας1 (n = 1 έως 7).
Αυτό μας βοηθά να δούμε ότι υπάρχει τότε μια γενίκευση σε άλλες ομάδες ή οικογένειες:
·Οικογένεια 2: Όλα έχουν 2 ηλεκτρόνια στο τελευταίο επίπεδο και η διαμόρφωση ηλεκτρονίων τελειώνει μας2.
·Οικογένεια 13: Όλα έχουν 3 ηλεκτρόνια στο τελευταίο επίπεδο και η διαμόρφωση ηλεκτρονίων τελειώνει μας2 np1.
·Οικογένεια 14: Όλα έχουν 4 ηλεκτρόνια στο τελευταίο επίπεδο και η διαμόρφωση ηλεκτρονίων τελειώνει μας2 np2.
·Οικογένεια 15: Όλα έχουν 5 ηλεκτρόνια στο τελευταίο επίπεδο και η διαμόρφωση ηλεκτρονίων τελειώνει μας2 np3.
·Οικογένεια 16: Όλα έχουν 6 ηλεκτρόνια στο τελευταίο επίπεδο και η διαμόρφωση ηλεκτρονίων τελειώνει μας2 np4.
·Οικογένεια 17: Όλα έχουν 7 ηλεκτρόνια στο τελευταίο επίπεδο και η διαμόρφωση ηλεκτρονίων τελειώνει μας2 np5.
- Εξωτερικά στοιχεία μετάβασης:
Τα στοιχεία μετάβασης είναι εκείνα που βρίσκονται σε οικογένειες από 3 έως 12, και τα εξωτερικά στοιχεία μετάβασης είναι εκείνα που είναι εκτεθειμένα (εξωτερικά). Στους παλιούς πίνακες, τα στοιχεία μετάβασης καταλαμβάνουν τις στήλες Β.
Έχουν το ηλεκτρόνιο πιο ενεργητικός πάνω σε ημιτελές επίπεδο. Η ηλεκτρονική σας διαμόρφωση τελειώνει μας2 (n-1) δ (1 έως 8).
Δείτε δύο παραδείγματα, των οποίων οι ρυθμίσεις είναι τώρα σε ενεργειακή σειρά:
28Νι: 1 δευτ2 2δ2 2ρ6 3δ2 3ρ6 4δ23δ8
39Υ: 1δ2 2δ2 2ρ6 3δ2 3ρ6 4δ2 3δ10 4ρ6 5 δευτ24δ1
- Στοιχεία εσωτερικής μετάβασης:
Είναι στοιχεία που καταλαμβάνουν την ομάδα 3 του Περιοδικού Πίνακα, αλλά παραμένουν εσωτερικά και, για να τα δούμε, τραβάμε μια γραμμή που επαναλαμβάνει τις περιόδους 6 και 7 κάτω από τον πίνακα. Η περίοδος 6 ονομάζεται σειρά λανθανίδης και η περίοδος 7 είναι η σειρά ακτινίδης.

Τα στοιχεία εσωτερικής μετάβασης έχουν το πιο ενεργητικό ηλεκτρόνιο του ατόμου στην κατάσταση του εδάφους σε ένα ημιτελές υποεπίπεδο f. Η ηλεκτρονική σας διαμόρφωση τελειώνει μας2 (n - 2) στ (1 έως 13).
Παράδειγμα με ηλεκτρονική διαμόρφωση με τάξη ισχύος:
57Λα: 1δ2 / 2 δευτ2 2ρ6 / 3 δευτ2 3ρ6 4δ2 3δ10 4ρ6 5 δευτ2 4δ10 5ρ66δ2 4στ1.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Διάγραμμα περιοδικού πίνακα και ενέργειας στοιχείου"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/tabela-periodica-diagrama-energia-dos-elementos.htm. Πρόσβαση στις 27 Ιουνίου 2021.