Όπως φαίνεται στα κείμενα "Ηλεκτρομαγνητικό φάσμα χημικών στοιχείων" και "Φάσμα εκπομπών και απορρόφησης και νόμοι του Kirchhoff", Τα ασυνεχή φάσματα εκπομπών κάθε χημικού στοιχείου είναι διαφορετικά.

Έτσι, παρακάτω έχουμε τα ξεχωριστά φάσματα ορισμένων από αυτά τα στοιχεία:

Έτσι, ο Δανός φυσικός Niels Böhr (1885-1962) συνειδητοποίησε ότι αυτό θα μπορούσε να σχετίζεται με τη δομή του ατόμου καθενός από αυτά τα στοιχεία. Ως εκ τούτου, πρότεινε ένα ατομικό μοντέλο που συμπλήρωσε το μοντέλο του Rutherford, αλλά επικεντρώθηκε στη συμπεριφορά των ηλεκτρονίων γύρω από τον πυρήνα του ατόμου.
Λίγο καιρό νωρίτερα, ο Max Planck (1858-1947) είχε προτείνει μια θεωρία ότι τα ηλεκτρόνια είναι ποσοτικοποιήθηκε, με την έννοια ότι αυτοί εκπέμπουν και απορροφούν συγκεκριμένες ποσότητες ενέργειας, σαν να ήταν μικρά πακέτα ενέργειας, το οποίο κάλεσε πόσο (ποσοστό, στον ενικό).
Έτσι, ο Böhr πρότεινε τα ακόλουθα: δεδομένου ότι κάθε στοιχείο έχει διαφορετικό φάσμα, κάθε στοιχείο έχει στο άτομο του ηλεκτρόνια σταθερών και διαφορετικών ενεργειών από στοιχείο σε στοιχείο.
Κάθε ηλεκτρόνιο μπορεί να παραμείνει μόνο σε μια συγκεκριμένη τροχιά, επειδή σε κάθε μια από αυτές τις τροχιές το ηλεκτρόνιο έχει σταθερή, καλά καθορισμένη και χαρακτηριστική ενέργεια. Το ηλεκτρόνιο μπορεί να καταλάβει μόνο τα επίπεδα ενέργειας για τα οποία έχει την αντίστοιχη ενέργεια.
Τα φάσματα είναι ασυνεχή επειδή τα ηλεκτρόνια κβαντοποιούνται.
Ένα ηλεκτρόνιο μπορεί να αλλάξει επίπεδα μόνο εάν απορροφά ενέργεια. Για παράδειγμα, όταν καίτε ένα άλας νατρίου σε έναν καυστήρα Bunsen, τροφοδοτείτε ενέργεια στα ηλεκτρόνια. Κατά την απορρόφηση ενός κβάντου ενέργειας, το ηλεκτρόνιο μεταβαίνει σε ένα άλλο πιο ενεργητικό επίπεδο, παραμένοντας στη διεγερμένη κατάσταση. Ωστόσο, η κατάσταση του εδάφους είναι πιο σταθερή, επομένως αυτό το ηλεκτρόνιο εκπέμπει την απορροφούμενη ενέργεια και επιστρέφει στην αρχική του τροχιά. Εκπέμπει αυτήν την ενέργεια με τη μορφή ηλεκτρομαγνητικών κυμάτων που μπορούν να απεικονιστούν με τη μορφή φωτός. Στην περίπτωση του νατρίου, αυτό το φως έχει έντονο κίτρινο χρώμα. Έτσι, όταν αυτά τα κύματα διέρχονται από ένα πρίσμα, λαμβάνεται το ασυνεχές φάσμα νατρίου.
Έτσι, για τον Böhr, κάθε φωτεινή γραμμή που εμφανίστηκε στο ασυνεχές φάσμα των στοιχείων έδειξε την ενέργεια που απελευθερώνεται όταν το ηλεκτρόνιο επέστρεψε από ένα εξωτερικό επίπεδο σε ένα πιο κοντά στον πυρήνα.
Το παρακάτω σχήμα βοηθά στην καλύτερη κατανόηση αυτού του ζητήματος:
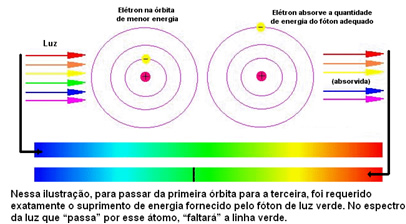
Καθώς τα άτομα κάθε στοιχείου επιτρέπονται μόνο ορισμένες τιμές ενέργειας που αντιστοιχούν στα ενεργειακά στρώματα, για κάθε στοιχείο υπάρχει ένα διαφορετικό φάσμα.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm


