Ο υπολογισμός του αριθμού των ατομικών σωματιδίων χρησιμοποιείται για να δείξει την ποσότητα των πρωτονίων (στον πυρήνα), των ηλεκτρονίων (στην ηλεκτρόσφαιρα) και των νετρονίων (στον πυρήνα) που υπάρχουν σε οποιοδήποτε άτομο ή ιόν. Για να γίνει αυτό, είναι σημαντικό να γνωρίζουμε ορισμένα χαρακτηριστικά των ατόμων:
1- Ατομικός αριθμός (Z)
Είναι ένας μαθηματικός κώδικας, που αντιπροσωπεύεται από το κεφαλαίο γράμμα Z, που βρίσκεται στην κάτω αριστερή πλευρά της συντομογραφίας ενός ατόμου:
ΖΧ
Δείχνει τον αριθμό των πρωτονίων (p) στον πυρήνα και τον αριθμό των ηλεκτρονίων (e) στην ηλεκτροσφαίρα ενός ατόμου. Έτσι, σε γενικές γραμμές:
Z = p = ε
2- Αριθμός μάζας (A)
Είναι ένας μαθηματικός κώδικας που αντιστοιχεί στο άθροισμα του αριθμού των πρωτονίων (p) και των νετρονίων (n), τα οποία υπάρχουν και τα δύο στον πυρήνα οποιουδήποτε ατόμου. Η εξίσωση που αντιπροσωπεύει τον αριθμό μάζας δίνεται από:
Α = p + n
Δεδομένου ότι ο αριθμός των πρωτονίων είναι ίσος με τον ατομικό αριθμό, μπορούμε να γράψουμε την εξίσωση για να υπολογίσουμε τον αριθμό μάζας ως εξής:
Α = Ζ + η
Εάν γνωρίζουμε τον αριθμό μάζας και τον ατομικό αριθμό ενός ατόμου, μπορούμε να προσδιορίσουμε τον αριθμό των νετρονίων ως εξής:
n = Α - Ω
3- ιόντα
Είναι άτομα που χάνουν ή αποκτούν ηλεκτρόνια. Έχουν ένα θετικό ή αρνητικό σημάδι τοποθετημένο στην επάνω δεξιά γωνία της αναπαράστασής τους, όπως στο ακόλουθο μοντέλο:
Χ+ ή Χ-
Θετικό ιόν: Αυτό ονομάζεται κατιόν και το θετικό σημάδι δείχνει ότι έχει χάσει ηλεκτρόνια.
Αρνητικό ιόν: Αυτό ονομάζεται ανιόν και το αρνητικό σημάδι δείχνει ότι έχει αποκτήσει ηλεκτρόνια.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
4- Ατομικές ομοιότητες
α) Ισότοπα
Άτομα που έχουν τον ίδιο ατομικό αριθμό και διαφορετικούς αριθμούς μάζας. Παράδειγμα:
7Χ14 και 7Γ16
Τα άτομα Χ και Υ έχουν τον ίδιο ατομικό αριθμό (στα αριστερά του αρκτικόλεξου), δηλαδή ίσο με 7. Το Atom X έχει αριθμό μάζας (στα δεξιά του αρκτικόλεξου) ίσο με 14 και το άτομο Y έχει αριθμό μάζας ίσο με 16.
β) Ισοβάρη
Άτομα που έχουν τον ίδιο αριθμό μάζας και διαφορετικούς ατομικούς αριθμούς. Παράδειγμα:
15Χ31 και 13Γ31
Τα άτομα Χ και Υ έχουν αριθμό μάζας (στα δεξιά του ακρωνύμιου) ίσο με 31. Το Atom X, από την άλλη πλευρά, έχει έναν ατομικό αριθμό ίσο με 15 και το άτομο Y έχει έναν ατομικό αριθμό ίσο με 13.
γ) Ισοτόνες
Άτομα που έχουν διαφορετικούς αριθμούς μάζας και ατομικούς αριθμούς, αλλά τον ίδιο αριθμό νετρονίων.
δ) Ισοηλεκτρονική
Άτομα που έχουν τον ίδιο αριθμό ηλεκτρονίων. Παράδειγμα:
12Χ+2 και 7Γ-3
Το Atom X έχει ατομικό αριθμό ίσο με 12 και είναι κατιόν (με θετικό φορτίο +2), έτσι χάνει δύο ηλεκτρόνια, έχοντας έτσι 10 ηλεκτρόνια στην ηλεκτροσφαίρα του. Το Atom Y, από την άλλη πλευρά, έχει ατομικό αριθμό ίσο με 7 και είναι ανιόν (με αρνητικό φορτίο -3), οπότε κερδίζει τρία ηλεκτρόνια, έχοντας έτσι 10 ηλεκτρόνια στην ηλεκτροσφαίρα του.
Χάρτης μυαλού: Ατομικά σωματίδια
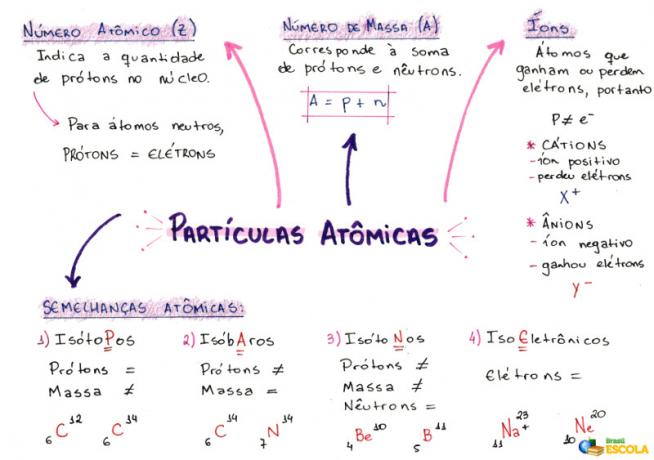
* Για να κατεβάσετε το χάρτη μυαλού σε PDF, Κάντε κλικ ΕΔΩ!
Παραδείγματα υπολογισμού του αριθμού των ατομικών σωματιδίων
Παράδειγμα 1: Προσδιορίστε τον αριθμό των πρωτονίων, των νετρονίων και των ηλεκτρονίων στο άτομο 14Χ29.
Δόθηκαν οι ακόλουθες τιμές για το άτομο X:
Αριθμός μάζας (πάνω δεξιά) = 29
Ατομικός αριθμός (κάτω αριστερά) = 14
Για να προσδιορίσετε τον αριθμό των πρωτονίων:
Ο αριθμός των πρωτονίων είναι πάντα ίσος με τον ατομικό αριθμό, έτσι το άτομο X έχει 14 πρωτόνια.
Για να προσδιορίσετε τον αριθμό των ηλεκτρονίων:
Καθώς το άτομο Χ δεν είναι ιόν, επομένως, ο αριθμός των ηλεκτρονίων είναι ίσος με τον αριθμό των πρωτονίων, δηλαδή, 14.
Για να προσδιορίσετε τον αριθμό των νετρονίων:
Ο αριθμός των νετρονίων προσδιορίζεται χρησιμοποιώντας τον αριθμό της μάζας και των πρωτονίων στον ακόλουθο τύπο:
Α = p + n
29 = 14 + ν
29 - 14 = ν
n = 15
Παράδειγμα 2: Προσδιορίστε τον αριθμό των πρωτονίων, των νετρονίων και των ηλεκτρονίων του ιόντος X+3, γνωρίζοντας ότι ο αριθμός μάζας και ο ατομικός αριθμός τους είναι, αντίστοιχα, 51 και 23.
Δίδονται οι ακόλουθες τιμές για το ιόν X:
Αριθμός μάζας = 51
Ατομικός αριθμός (κάτω αριστερά) = 23
Για να προσδιορίσετε τον αριθμό των πρωτονίων:
Ο αριθμός των πρωτονίων είναι πάντα ίσος με τον ατομικό αριθμό, έτσι το άτομο X έχει 23 πρωτόνια.
Για να προσδιορίσετε τον αριθμό των ηλεκτρονίων:
Το ιόν Χ είναι θετικό (+3), άρα είναι ένα κατιόν που έχει χάσει τρία ηλεκτρόνια. Έτσι, ο αριθμός των ηλεκτρονίων είναι 20.
ΣΗΜΕΙΩΣΗ: Η μείωση ή αύξηση του αριθμού των ηλεκτρονίων συμβαίνει πάντα σε σχέση με τον ατομικό αριθμό.
Για να προσδιορίσετε τον αριθμό των νετρονίων:
Ο αριθμός των νετρονίων προσδιορίζεται χρησιμοποιώντας τον αριθμό της μάζας και των πρωτονίων στον ακόλουθο τύπο:
Α = p + n
51 = 23 + η
51 - 23 = ν
n = 28
Παράδειγμα 3: Ένα άτομο W έχει ατομικό αριθμό και μάζα ίση με, αντίστοιχα, 29 και 57, που είναι ισοβαρή του α άτομο Υ, που έχει ατομικό αριθμό ίσο με 30, που είναι ισότοπο ατόμου Β, του οποίου ο αριθμός μάζας είναι 65. Με αυτές τις πληροφορίες, προσδιορίστε τον αριθμό των πρωτονίων, των νετρονίων και των ηλεκτρονίων στο άτομο Β.
Δεδομένα που παρέχονται από την άσκηση:
Atom W
ατομικός αριθμός (κάτω αριστερά) = 29
αριθμός μάζας (πάνω δεξιά) = 57
Y isobar, δηλαδή η μάζα του Y είναι επίσης 57.
Υ άτομο
ατομικός αριθμός = 30
αριθμός μάζας = 57
Με αυτές τις δύο τιμές, πρέπει να προσδιορίσουμε τον αριθμό νετρονίων του, επειδή είναι ισοτόνη του στοιχείου Β:
Α = Ζ + η
57 = 30 + η
57 - 30 = ν
η = 27
Άτομο Β:
αριθμός μάζας = 65
αριθμός νετρονίων = 27
Με αυτά τα δεδομένα, πρέπει να προσδιορίσουμε τον ατομικό αριθμό του, διότι με αυτό, θα προσδιορίσουμε τον αριθμό των πρωτονίων και τον αριθμό των ηλεκτρονίων του (δεδομένου ότι δεν είναι ένα ιόν):
Α = Ζ + η
65 = Ζ +27
65 - 27 = Ζ
Ζ = 38
Επομένως, το άτομο Β έχει 38 πρωτόνια, 38 ηλεκτρόνια και 27 νετρόνια.
* Χάρτης μυαλού από τον Victor Ricardo Ferreira
Καθηγητής Χημείας
Από μένα. Diogo Lopes Dias