Αιθέρας Είναι μια οξυγονωμένη οργανική λειτουργία, δηλαδή, έχει το χημικό στοιχείο οξυγόνο, εκτός από τον άνθρακα και το υδρογόνο. Αυτή η συνάρτηση έχει ως κύριο δομικό χαρακτηριστικό την παρουσία δύο οργανικές ρίζες προσαρτημένο σε άτομο οξυγόνου.
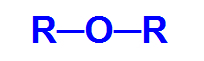
Γενικός συντακτικός τύπος αιθέρα
Έτσι, η ανθρακική αλυσίδα ενός αιθέρα είναι ετερογενής και μπορεί να έχει δύο ίδιες ή διαφορετικές ρίζες, είτε αλκύλιο, τύποι ριζών που δεν έχουν αρωματική δομή, ή αρύλιο, ρίζες που δεν έχουν δομή αρωματικός.
Φυσικά χαρακτηριστικά του αιθέρα
Όσον αφορά τη φυσική κατάσταση σε θερμοκρασία δωματίου: όταν το αιθέρας έχει τέσσερα ή περισσότερα άτομα άνθρακα στη σύνθεσή του, είναι υγρό.
Όσον αφορά το σημείο τήξεως και το σημείο βρασμού: σε σύγκριση με άλλες οργανικές ενώσεις μάζας κατά προσέγγιση γραμμομοριακή, έχουν σημείο τήξης παρόμοιο με αυτό των αλκανίων και χαμηλότερο από τα υπόλοιπα συστατικά οργανικός;
Όσον αφορά την πυκνότητα: είναι ενώσεις που έχουν μικρή πυκνότητα σε σύγκριση με το νερό.
Όσον αφορά τις δυνάμεις αλληλεπίδρασης: οι αιθέρες συντίθενται με χαμηλή πολικότητα, αλληλεπιδρούν μεταξύ τους μέσω μιας αδύναμης μόνιμης διπολικής αλληλεπίδρασης. Με νερό και αλκοόλες, οι αιθέρες έχουν την ικανότητα να αλληλεπιδρούν μέσω δεσμών υδρογόνου.
Οσον αφορα στο πόλωση: είναι ενώσεις που έχουν γωνιακή γεωμετρία, επομένως, είναι πολικές.
Όσον αφορά το οργανοληπτικό χαρακτηριστικό: είναι ουσίες που εκπέμπουν μια πολύ ευχάριστη μυρωδιά, αλλά η εισπνοή τους μπορεί να προκαλέσει εξάρτηση.
Επίσημη ονοματολογία αιθέρα
Μικρό πρόθεμα στελέχους + oxy + κύριο πρόθεμα στελέχους + infix + o
Για την εκτέλεση της επίσημης ονοματολογίας του α αιθέρας, Είναι σημαντικό να προσδιορίσετε ποιος είναι ο κύριος συνδέτης σας και ποιος είναι ο δευτερεύων συνδέτης σας. Για να το κάνετε αυτό, ακολουθήστε δύο παραδείγματα εφαρμογής για αυτόν τον κανόνα ονομασίας παρακάτω:
1ο Παράδειγμα:
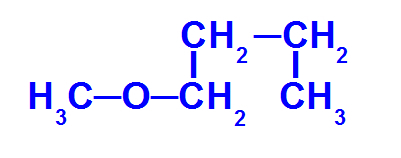
Δομικός τύπος αιθέρα με λιγότερους άνθρακες
Ο παραπάνω αιθέρας έχει τις ακόλουθες ρίζες:
Μεθύλιο (CH3-);
Βουτύλιο (CH3-CH2-CH2-CH2-).
Για να ονομάσουμε αυτήν την ένωση, έχουμε:
πρόθεμα δευτερεύουσας ρίζας: Met
+
οξυ
+
κύριο πρόθεμα στελεχών: αλλά
+
ένα (επειδή έχει μόνο μεμονωμένους συνδέσμους)
+
Ο
Λοιπόν, το όνομα αυτού αιθέρας θα είναι μεθοξυβουτάνιο.
2ο Παράδειγμα:
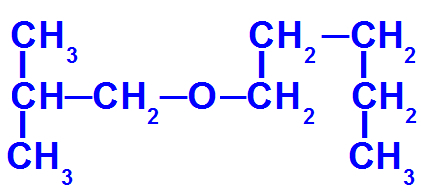
Δομικός τύπος αιθέρα με περισσότερους άνθρακες
Αυτός ο αιθέρας έχει τις ακόλουθες ρίζες:
Ισοβουτύλιο [(CH3)2-CH-CH2-);
πεντύλιο (CH3-CH2-CH2-CH2-CH2).
Για να το ονομάσουμε, επομένως, έχουμε:
μικρό ριζικό πρόθεμα: isobut
+
οξυ
+
κύριο πρόθεμα στελεχών: pent
+
ένα (επειδή έχει μόνο μεμονωμένους συνδέσμους)
+
Ο
Έτσι, το όνομα του αιθέρας εν λόγω θα είναι ισοβουτοξυπεντάνιο.
Συνήθης ονοματολογία αιθέρα
Αιθέρας + όνομα ριζών (απλούστερος και μετά πιο περίπλοκος) + ico
ή
Ριζοσπαστικά ονόματα + αιθέρας
Ακολουθήστε παρακάτω δύο παραδείγματα εφαρμογής για αυτόν τον κανόνα ονομασίας:
1ο Παράδειγμα:

Δομικός τύπος αιθέρα που έχει τέσσερις άνθρακες
Οτι αιθέρας παρουσιάζει τις ακόλουθες ρίζες:
Μεθύλιο (CH3);
Ισοπροπύλιο (CH3-CH-CH3).
Έτσι, για αυτήν την ένωση, έχουμε:
Αιθέρας
+
δευτερεύουσα ρίζα: Μεθύλιο
+
κύριο ριζικό πρόθεμα: ισοπροπύλιο
+
ich
Έτσι, το όνομα του αιθέρας εν λόγω θα είναι μεθυλ ισοπροπυλαιθέρας, αλλιώς μεθυλ ισοπροπυλαιθέρας.
2ο Παράδειγμα:

Δομικός τύπος αιθέρα που έχει πέντε άνθρακες
Ο παραπάνω αιθέρας έχει τις ακόλουθες ρίζες:
Αιθύλιο (CH3-CH2-);
Προπύλιο (CH3-CH2-CH2-).
Για να ονομάσουμε αυτήν την ένωση, έχουμε:
Αιθέρας
+
δευτερεύουσα ρίζα: αιθύλιο
+
κύριο ριζικό πρόθεμα: προπύλιο
+
ich
Έτσι, το όνομα του αιθέρας εν λόγω θα είναι αιθυλ προπυλαιθέρας, ο οποίος μπορεί επίσης να είναι αιθυλ προπυλαιθέρας.
Χρήσεις αιθέρων
Γενικά, χρησιμοποιούνται αιθέρες:
Ως αδρανείς οργανικοί διαλύτες, δηλαδή δεν συμμετέχουν σε καμία αντίδραση.
Χρησιμοποιείται στην εξαγωγή αποστάξεων, όπως λουλουδιών, ξύλου κ.λπ.
Χρησιμοποιείται στην εξαγωγή διαφόρων ελαίων και λιπών.
Από μένα. Diogo Lopes
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm
