Στο κείμενο "Igneous ηλεκτρόλυση», Εξηγήθηκε ότι αυτή η διαδικασία συμβαίνει όταν ένα ηλεκτρικό ρεύμα διέρχεται σε λιωμένη ουσία (σε υγρή κατάσταση), χωρίς την παρουσία νερό και, με αυτόν τον τρόπο, το κατιόν δέχεται ηλεκτρόνια και το ανιόν δωρίζει ηλεκτρόνια, έτσι ώστε και τα δύο να έχουν ηλεκτρικό φορτίο ίσο με μηδέν και ενέργεια συσσωρευμένος.
Για να κατανοήσουμε καλύτερα πώς συμβαίνει η πύρινη ηλεκτρόλυση, ας εξετάσουμε ένα από τα πιο σημαντικά παραδείγματα αυτού του τύπου διεργασίας, την ηλεκτρόλυση του χλωριούχου νατρίου ή του επιτραπέζιου άλατος (NaCl).
Το χλωριούχο νάτριο σχηματίζεται στη φύση μέσω της μεταφοράς ενός ηλεκτρονίου από νάτριο (Na) σε χλώριο (Cl), σύμφωνα με την παρακάτω αντίδραση:
2Na (s) + 1Cl2(g) → 2NaCl (s)

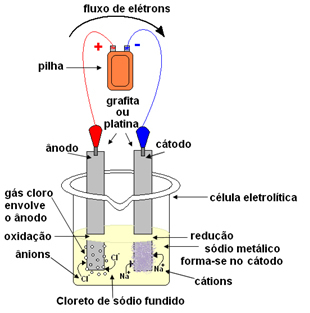
Αυτή η διαδικασία είναι αυθόρμητη, αλλά η αντίστροφη διαδικασία αυτής της αντίδρασης δεν είναι αυθόρμητη, δηλαδή, η παραγωγή αερίου χλωρίου (Cl2(ζ) - σχήμα παρακάτω) και μεταλλικό νάτριο (Na (s)) δεν εμφανίζεται στη φύση. Εάν θέλουμε να συμβεί αυτό, θα πρέπει να ξεκινήσουμε τη διαδικασία.
Αυτό μπορεί να γίνει με πύρινη ηλεκτρόλυση. Το άλας θερμαίνεται σε θερμοκρασία άνω των 800,4 ° C, που είναι το σημείο τήξης του. και με αυτόν τον τρόπο συγχωνεύεται, περνώντας από στερεό σε υγρό. Σε αυτήν τη φυσική κατάσταση, τα ιόντα σας+ και Cl- είναι δωρεάν.
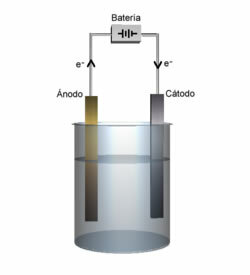
Το τετηγμένο άλας στη συνέχεια τοποθετείται σε ένα δοχείο, το ηλεκτρολυτικό δοχείο, και δύο ηλεκτρόδια αδρανούς λευκοχρύσου ή γραφίτη βυθίζονται στο χλωριούχο νάτριο. Αυτά τα ηλεκτρόδια συνδέονται με μια πηγή που παράγει άμεσο ηλεκτρικό ρεύμα, όπως μια μπαταρία ή μια κυψέλη.
Με τη διέλευση του ηλεκτρικού ρεύματος, συμβαίνουν τα εξής:
- Ο αρνητικός πόλος της μπαταρίας ή της κυψέλης παρέχει ηλεκτρόνια σε ένα από τα ηλεκτρόδια, το οποίο γίνεται η κάθοδος.
- Κάθοδος: λαμβάνει τα ηλεκτρόνια από το κελί και γίνεται ο αρνητικός πόλος, προσελκύοντας τα κατιόντα Na+, επειδή οι αντίθετες χρεώσεις προσελκύουν. Αυτά τα ιόντα δέχονται τα ηλεκτρόνια από το ηλεκτρόδιο (κάθοδος) και λαμβάνει χώρα η αναγωγή τους, σχηματίζοντας μεταλλικό νάτριο:
Μείωση:Στο+(ℓ) + και- → Σε(μικρό)
Μεταλλικό νάτριο εναποτίθεται πάνω από το ηλεκτρόδιο και αποστέλλεται σε δεξαμενή.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
- Ανοδος: γίνεται θετικά φορτισμένος, προσελκύοντας Cl ανιόντα- (γι 'αυτό ονομάζεται άνοδος). Αυτά τα ιόντα χάνουν τα ηλεκτρόνια τους όταν έρχονται σε επαφή με την άνοδο και, επομένως, υφίστανται οξείδωση, σχηματίζοντας άτομα χλωρίου, τα οποία συνδυάζουν αμέσως δύο προς δύο για να σχηματίσουν αέριο χλώριο:
Οξείδωση:2Cl-(ℓ) → 2 και- +1Cl2(σολ)
Αυτό το αέριο διοχετεύεται γύρω από την άνοδο και συλλέγεται από έναν γυάλινο σωλήνα προσαρμοσμένο στο σύστημα.
Έτσι, η συνολική αντίδραση που εμφανίζεται σε αυτήν την περίπτωση δίνεται από:
Κάθοδος: 2Na+(ℓ) + 2ε- → 2Να(μικρό)
Άνοδος: 2Cl-(ℓ) → 2 και- +1Cl2(ζ) ____________
Παγκόσμια αντίδραση: 2Na+(ℓ) + 2Cl-(ℓ) → 2Να(μικρό) +1Cl2(σολ)
Μια άλλη σημαντική πτυχή που πρέπει να γνωρίζετε, η οποία επισημάνθηκε στο τέλος του αναφερόμενου κειμένου (Igneous Electrolysis), είναι ότι, για την ηλεκτρόλυση συμβαίνει, η κυψέλη ή η μπαταρία που χρησιμοποιείται για την παραγωγή ηλεκτρικού ρεύματος πρέπει να έχει ddp (διαφορά δυναμικού) ίση ή μεγαλύτερη από τη διαφορά δυναμικού του αντίδραση.
Ας το δούμε αυτό στην περίπτωση της ηλεκτρόλυσης χλωριούχου νατρίου που εξετάζουμε. Για να ανακαλυφθεί η πιθανή διαφορά αυτής της αντίδρασης, αρκεί να μειωθεί το τυπικό δυναμικό μείωσης της καθόδου από εκείνο της ανόδου. Αυτό εξηγείται στο κείμενο. Πιθανή διαφορά μπαταρίας .
Μέσω του πίνακα τυπικών δυνατοτήτων μείωσης (Ε0κόκκινο), γνωρίζουμε ότι:
Στο+(ℓ) + και- → Σε(μικρό) ΚΑΙ0κόκκινο = -2,71
2Cl-(ℓ) → 2 και- +1Cl2(ζ) ΚΑΙ0κόκκινο = +1.36
Τώρα, απλώς μειώστε αυτές τις τιμές για να μάθετε την πιθανή διαφορά της παγκόσμιας αντίδρασης:
Δ και0 = ΚΑΙ0κόκκινο (κάθοδος) - ΚΑΙ0κόκκινο (άνοδος)
Δ και0 = -2,71 – (+ 1,36)
Δ και0 = - 4,07 V
Επομένως, αυτό σημαίνει ότι η κυψέλη ή η μπαταρία που θα χρησιμοποιηθεί πρέπει να έχει τάση ίση ή μεγαλύτερη από 4,07V για τη διεξαγωγή της πυριτικής ηλεκτρόλυσης του χλωριούχου νατρίου.
Η αρνητική τιμή δείχνει μόνο ότι είναι μια μη αυθόρμητη διαδικασία.. Στην περίπτωση των μπαταριών, η οποία είναι μια αυθόρμητη διαδικασία, η τιμή της ηλεκτροκινητικής δύναμης (ΔE0) δίνει πάντα θετικό.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ηλεκτρόλυση Igneous Sodium Chloride"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm. Πρόσβαση στις 28 Ιουνίου 2021.
ε) Είναι μια αυθόρμητη διαδικασία οξειδοαναγωγής.
Χημεία

Εφαρμογές Ηλεκτρόλυσης, ηλεκτρολυτικής επικάλυψης, επιμετάλλωσης νικελίου, επιχρωμίωσης, νικελίου, χρωμίου, καθόδου, νατρίου, αργιλίου, χλωρίου, καυστική σόδα, αέριο υδρογόνο, πυριτική ηλεκτρόλυση, υδατική ηλεκτρόλυση, αλκαλικά μέταλλα, αλκαλική γη, αέριο χλώριο.
Χημεία

Ηλεκτρόλυση, διαλύματα ηλεκτρολυτών, ηλεκτρικό ρεύμα, αντιδράσεις μείωσης οξείδωσης, αυθόρμητη χημική διαδικασία, χημική διαδικασία μη αυθόρμητος, μετασχηματιστής, τεχνητός μετασχηματισμός, βιομηχανίες, αλκαλικά μέταλλα, αλκαλική γη, αέριο υδρογόνο, αέριο cl