Ο υπολογισμός του δυναμικού ενός μπαταρία εκτελείται όταν θέλετε να μάθετε εκ των προτέρων (πριν από τη συναρμολόγηση) ποια θα είναι η τάση, emf (ηλεκτροκινητική δύναμη) ή ddp (πιθανή διαφορά) που ένα δεδομένο κελί θα παράγει από δύο μέταλλα με διαφορετικά χαρακτηριστικά.
Ο όρος χρησιμοποιήθηκε εκ των προτέρων επειδή, εάν θέλουμε να μετρήσουμε την τάση οποιασδήποτε συσκευής, είτε κυψέλης είτε μπαταρίας, πρέπει απλώς να χρησιμοποιήσουμε ένα πολύμετρο.
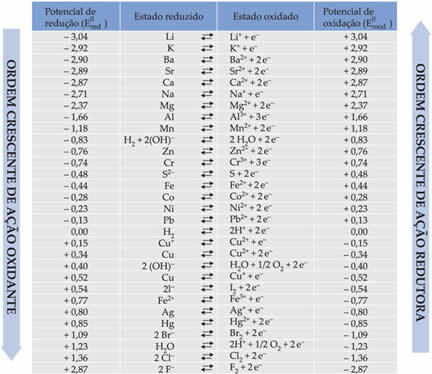
Κάθε μέταλλο που συμμετέχει στη σύνθεση της ανόδου και της καθόδου του κελιού έχει διαφορετικό ικανότητες να υποστούν οξείδωση (ικανότητα απώλειας ηλεκτρονίων) και μείωση (ικανότητα κέρδους ηλεκτρόνια). Αυτή η ικανότητα οξειδώσεως ή μείωσης ονομάζεται δυναμικό. Επομένως, τα μέταλλα που αποτελούν το ηλεκτρόδιο μιας κυψέλης μπορεί να έχουν:
Τυπικό δυναμικό μείωσης (Eτο κόκκινο): είναι η ικανότητα του ηλεκτροδίου να υποστεί το φαινόμενο μείωσης. Αυτό το δυναμικό μετριέται σε βολτ (V) και η τιμή του είναι η ίδια με το τυπικό δυναμικό οξείδωσης, αλλά με το αντίθετο σημείο.
Τυπικό δυναμικό οξείδωσης (Eοξυ): είναι η ικανότητα του ηλεκτροδίου να υποφέρει το φαινόμενο της οξείδωσης. Αυτό το δυναμικό μετριέται σε βολτ (V) και η τιμή του είναι η ίδια με το τυπικό δυναμικό μείωσης, αλλά με το αντίθετο σύμβολο.
ΣΗΜΕΙΩΣΗ: Ένα τυπικό δυναμικό μπορεί να επηρεαστεί από τη θερμοκρασία και τη συγκέντρωση των διαλυμάτων που χρησιμοποιούνται για τη συναρμολόγηση του σωρού.
Να εκτελέσει υπολογίζοντας το δυναμικό μιας μπαταρίας, Πρέπει να γνωρίζουμε τις τιμές των τυπικών δυνατοτήτων, είτε οξείδωσης είτε μείωσης, και να ισχύουν στα ακόλουθα Μαθηματική εξίσωση:
ΔΕ = Ετο κόκκινο (μεγαλύτερο) - Καιτο κόκκινο (μικρότερος)
ή
ΔΕ = Εοξυ (μεγαλύτερο) - Καιοξυ (μικρότερος)
ΔE = παραλλαγή του δυναμικού μιας μπαταρίας (emf ή ddp).
Αυτή η εξίσωση χρησιμοποιεί την πιθανή διακύμανση επειδή, όπως στη συσκευή, συμβαίνει οξείδωση και μείωση, το μέτρο του δυναμικού θα δοθεί απλά αφαιρώντας το δυναμικό καθενός από τα ηλεκτρόδια (μέταλλα).
ΣΗΜΕΙΩΣΗ: Μπορούμε να πούμε ότι δουλεύουμε με ένα stack όταν το ντουπολογισμός των πιθανών αποτελεσμάτων σε θετική τιμή.
Τώρα ακολουθήστε μερικά παραδείγματα ερωτήσεων που αφορούν το ντουπολογισμός του δυναμικού μιας μπαταρίας:
Παράδειγμα 1: (UFSC-SP) Δεδομένων των ημι-αντιδράσεων:
2 Φε+2 → 2 Φε+3 + 2 και Εοξυ = - 0,77 V
2 Cl-1 → 1 Cl2 + 2 και Εοξυ = - 1,36V
Υπολογίστε την πιθανότητα της αντίδρασης παρακάτω (στοίβα) και πείτε εάν είναι αυθόρμητη ή όχι, ελέγχοντας τη σωστή επιλογή:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
2 Φε+2 + Cl2 → 2 Φε+3 + 2 Cl-1
a) - 0,59V, δεν είναι αυθόρμητο
β) 0,59 V, δεν είναι αυθόρμητο
γ) 0,59 V, είναι αυθόρμητο
d) - 2,13 V, δεν είναι αυθόρμητο
ε) 2,13 V, είναι αυθόρμητο
Ανάλυση:
Καθώς η άσκηση σας ζητά να προσδιορίσετε την τιμή του δυναμικού της μπαταρίας, απλώς αναλύστε τις δυνατότητες οξείδωσης που παρέχονται για να κρίνετε ποιο είναι το υψηλότερο και ποιο είναι το χαμηλότερο:
2 Φε+2 → 2 Φε+3 + 2 και Εοξυ = - 0,77 V (Αυτό είναι το μεγαλύτερο)
2 Cl-1 → 1 Cl2 + 2 και Εοξυ = - 1,36V (Αυτό είναι το μικρότερο)
Στη συνέχεια, απλώς εφαρμόστε τον στον τύπο υπολογισμού του δυναμικού μιας μπαταρίας:
ΔΕ = Εοξυ (μεγαλύτερο) - Καιοξυ (μικρότερος)
ΔΕ = - 0,77 - (-1,36)
ΔΕ = - 0,77 + 1,36
ΔΕ = + 0,59V
Καθώς το δυναμικό που βρέθηκε έχει θετική αξία, έχουμε μια αυθόρμητη διαδικασία. Γράμμα ντο).
Παράδειγμα 2: (UFMS) Εξετάστε τις ημι-αντιδράσεις, που αναφέρονται παρακάτω, με τις αντίστοιχες τυπικές δυνατότητες μείωσής τους, σε βολτ (V):
Αγ+ + και → Ag Eτο κόκκινο = 0,80V
Γάιδαρος+2 + 2 και → Cu Eτο κόκκινο = 0,34V
Υπολογίστε την πιθανότητα της αντίδρασης παρακάτω (στοίβα) και πείτε εάν είναι αυθόρμητη ή όχι, ελέγχοντας τη σωστή επιλογή:
Cu + 2 Ag+→ Cu+2 + 2 Ag
α) - 4,6 V
β) - 0,46 V
γ) + 0,46 V
δ) + 1,14V
ε) - 1,14 V
Ανάλυση:
Καθώς η άσκηση σας ζητά να καθορίσετε την αξία του δυναμικού της στοίβας, απλά πρέπει να κοιτάξετε τις παρεχόμενες δυνατότητες μείωσης για να κρίνετε ποια είναι η μεγαλύτερη και ποια είναι η μικρότερη:
Αγ+ + και → Ag Eτο κόκκινο = 0,80V (Αυτό είναι το μεγαλύτερο)
Γάιδαρος+2 + 2 και → Cu Eτο κόκκινο = 0,34V (Αυτό είναι το μικρότερο)
Στη συνέχεια, απλώς εφαρμόστε τον στον τύπο υπολογισμού του δυναμικού μιας μπαταρίας:
ΔΕ = Ετο κόκκινο (μεγαλύτερο) - Καιτο κόκκινο (μικρότερος)
ΔE = 0,80 - (0,34)
ΔΕ = 0,80 - 0,34
ΔΕ = + 0,46V
Καθώς το δυναμικό που βρέθηκε έχει θετική αξία, έχουμε μια αυθόρμητη διαδικασία. Γράμμα ντο).
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Υπολογισμός του δυναμικού ενός κελιού". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/calculo-potencial-uma-pilha.htm. Πρόσβαση στις 28 Ιουνίου 2021.