Hitzelatent ist die Menge von EnergieThermal- die von einem Körper oder thermodynamischen System bei einer Änderung seines physikalischen Zustands aufgenommen oder abgegeben wird, im konstante Temperatur.
Wenn ein reiner Stoff seine Temperatur von. erreicht Verschmelzung oder Sieden, während des Aufwärmens beginnt sich Ihr körperlicher Zustand zu ändern. Dabei nimmt es weiterhin Wärme auf, jedoch ist seine TemperaturÜberresteKonstante. Dies geschieht, weil beim Erreichen dieser Temperaturen, bei denen physikalische Zustandsänderungen auftreten, die gesamte vom thermodynamischen System aufgenommene Wärme zur Überwindung der EnergiePotenzial das hält seine Moleküle zusammen. Sobald das thermodynamische System die gesamte Energie aufnimmt, die zum Aufbrechen seiner Moleküle erforderlich ist, nimmt die Wechselwirkung zwischen ihnen ab, was darauf hindeutet, dass sich ihr Aggregatzustand geändert hat. Nach der Zustandsänderung wird die aufgenommene Wärme isotherm wird weiterhin von den Molekülen aufgenommen und versorgt sie
EnergieKinetik. Diese Art von Wärme, die die kinetische Energie von Molekülen erhöht, heißt spürbare Hitze.Aussehenebenfalls: Sieben „Gold“-Tipps für ein effektiveres Physikstudium
Ö Hitzelatent misst die Wärmemenge pro Masseneinheit, die für jede Änderung in needed benötigt wird physikalischer Zustand des Körpers, also seine Maßeinheit nach dem Internationalen System (SI), ist der JouleproKilogramm (J/kg). Die Verwendung anderer Einheiten wie z KalorieproGramm (cal/g) ist in der Kalorimetrie weit verbreitet.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Arten von latenter Wärme
Es gibt zwei Arten von Hitze: o HitzewennNiveau es ist das Hitzelatent. Sensible Wärme ist die Wärme, die bei Temperaturänderungen zwischen Körpern übertragen wird. Latente Wärme wiederum tritt auf, wenn es zu Wärmeübertragungen ohne Temperaturänderungen kommt.
Die latente Wärme wird für verschiedene Änderungen des physikalischen Zustands verändert. Sehen Sie sich die verschiedenen Arten von latenter Wärme an:
latente WärmeimFusion (LF): es ist die Wärme, die die Körper während des Fusionsprozesses aufnehmen oder abgeben: von flüssig zu fest und umgekehrt bei konstanter Temperatur.
latente WärmeimVerdampfung (LV): ist diejenige, die bei Fest-Flüssig- oder Flüssig-Fest-Umwandlungen übertragen wird, im konstante Temperatur.
Aussehenebenfalls: Was ist Wärmekapazität?
BeispieleimHitzelatent
Sehen Sie sich einige alltägliche Situationen an, in denen es zu einem latenten Wärmeaustausch kommt:
Wenn wir das Wasser auf eine Temperatur von 100 °C erhitzen, beginnt der Verdampfungsprozess. Solange sich nicht alles Wasser in Dampf verwandelt, ändert sich seine Temperatur nicht.
Wenn wir Wasser auf eine sehr heiße Oberfläche gießen, verdampft das gesamte Wasser fast sofort. Dieser Vorgang wird als Erwärmung bezeichnet und beinhaltet die Aufnahme von latenter Wärme.
Es findet ein latenter Wärmeaustausch statt, wenn wir eine Sodaflasche bei niedrigen Temperaturen und ihren gesamten Inhalt berühren gefriert schnell bei konstanter Temperatur, dank seiner Temperatur unter dem Schmelzpunkt von Wasser.
latente Wärmeformel
Die latente Wärme berechnet sich aus dem Verhältnis der bei der isothermen Umwandlung übertragenen Wärmemenge:
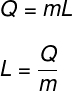
Q – übertragene Wärmemenge
ich - Körpermasse
L – latente Wärme
Phasenänderungen und latente Wärme
Phasenänderungen in Reinstoffen treten auf imTemperaturKonstante, indem sie latente Wärme aufnimmt oder abgibt. Alle Reinstoffe haben a Heizkurve ähnlich dem Bild unten:
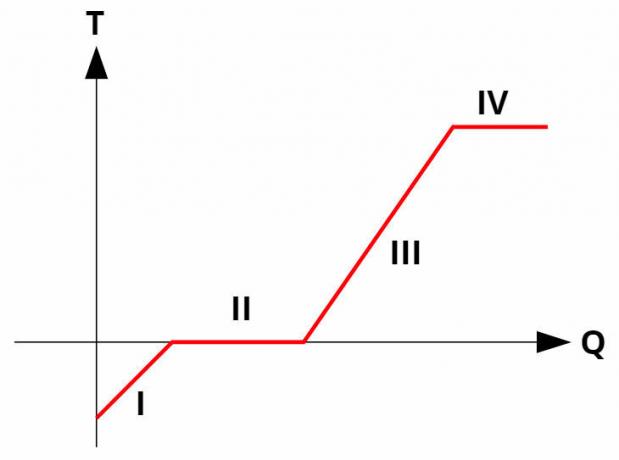
Beim KurvenimHeizung sie beziehen die Temperatur (y-Achse) auf die abgegebene oder empfangene Wärmemenge (x-Achse). Bei Phasenwechseln (Verfahren II und IV) bleibt die Temperatur konstant, obwohl noch Wärmeaustausch stattfindet.
Auch sehen: Grundlagen der Kalorimetrie
Latentwärmetabelle
Unter normalen Bedingungen von Temperatur und Druck, Ö Hitzelatent des Wassers für seine unterschiedlichen Aggregatzustandsänderungen ist in der folgenden Tabelle aufgeführt:
Transformation |
Latente Wärme (cal/g) |
Schmelzen (0°C) |
80 |
Erstarrung (0°C) |
-80 |
Verdampfung (100°C) |
540 |
Kondensation (100°C) |
-540 |
Nach der oben gezeigten Tabelle, 80Kalorien frieren 1 GrammWasser bei der Schmelztemperatur (0 °C). Die negativen Vorzeichen im Prozesse von Erstarrung und Kondensation zeigen an, dass in ihnen Wärme freigesetzt wurde, also sind diese beiden Umwandlungen exotherm. Die folgende Tabelle zeigt die latente Wärme in J/kg, für die gleichen Prozesse:
Transformation |
Latentwärme (J/kg) |
Schmelzen (0°C) |
333.103 |
Erstarrung (0°C) |
-333.103 |
Verdampfung (100°C) |
2,2.106 |
Kondensation (100°C) |
-2,2.106 |

Latentwärmeübungen
1) Ein Behälter fasst 500 g flüssiges Wasser. Ohne Änderung der Wassertemperatur verdampft der gesamte Inhalt plötzlich. Bestimmen Sie, wie viel Wärme auf den Inhalt dieses Behälters übertragen wurde.
Daten: LF = 540 cal/g
Auflösung:
Um die Wärmemenge zu berechnen, die zum Verdampfen dieser Wassermasse benötigt wird, verwenden wir die folgende Formel:
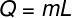
Unter Verwendung der von der Übung bereitgestellten Daten führen wir die folgende Berechnung durch:
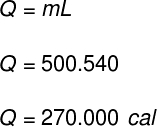
Von mir. Rafael Helerbrock
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
HELERBROCK, Rafael. "Latente Hitze"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/fisica/calor-latente.htm. Zugriff am 27. Juni 2021.