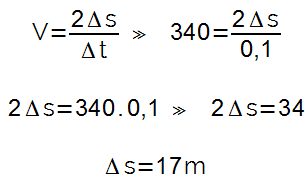Wenn wir darüber reden pH, beziehen wir uns auf das Hydrogenionenpotential einer Lösung, also die Menge an Hydroniumkationen (H+ oder H3Ö+), die im Lösungsmittel einer Lösung dispergiert sind.
Hydroniumkationen sind aufgrund der vom Wissenschaftler vorgeschlagenen Definition gut bekannt Arhenius für eine Säure. Dieser Wissenschaftler behauptet, dass Acid ist jede Substanz in der Lage ionisieren und produzieren Hydroniumionen in einem wässrigen Medium.

Säureionisationsgleichung
Das Akronym pH dient als Referenz zur Bestimmung des Säuregehalts eines Mediums. Aber auch Chemiker nutzen die pH als Referenz, um neben dem Säuregehalt zu bestimmen, ob ein Medium basisch oder neutral ist.
Dies ist möglich, weil Chemikern jetzt bekannt ist, dass Wasser eine Selbstionisierung erfährt, d. h., es produziert Hydronium (H+) und Hydroxide (OH-). Eine wässrige Lösung enthält also nie nur Hydronium oder Hydroxid, sondern beides, wie wir an der folgenden Gleichung sehen können:

Wasser-Autoionisationsgleichung
Werte als Referenz für pH
Die verwendeten Werte für die pH beziehen sich auf die Ionisationskonstante (Kw) von Wasser bei einer Temperatur von 25ÖC, das gleich 10. ist-14. Bei dieser Temperatur sind die Konzentrationen von Hydronium- und Hydroxidionen, die von Wasser produziert werden, absolut gleich, dh 10-7 mol/l.
[H+]=[OH-]= 10-7
Aus dieser Referenz stammen die für den pH-Wert verwendeten Werte von 0 bis 14.
Formeln zur Berechnung des pH
a) Berechnung aus der Konzentration in mol/L an Hydronium-Kationen
Die Berechnung des pH-Wertes kann direkt erfolgen, sofern wir die Konzentration an Hydronium ([H+]). Aussehen:
pH = -log[H+]
oder
10-pH = [H+]
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
b) Berechnung aus der Konzentration der Hydroxid-Anionen (OH-)
pOH = -log[OH-]
oder
10-pOH = [OH-]
Nachdem Sie den pOH-Wert berechnet haben, müssen Sie ihn im folgenden Ausdruck verwenden, um den pH-Wert zu bestimmen.
pH + pOH = 14
Interpretation von pH-Werten
Anhand des pH-Wertes können wir feststellen, ob die jeweilige Lösung sauer, basisch oder neutral ist. Verwenden Sie dazu einfach die folgende schematische Beziehung:
Für pH-Werte unter 7 = saures Medium;
Für pH mit einem Wert gleich 7 = neutrales Medium;
Bei pH-Werten über 7 = basisches Medium.
Beispiele
1. Beispiel: Wissen, dass die Konzentration von Hydronium-Kationen in einer Lösung 2,10. beträgt-4 mol/L, welchen pH-Wert sollte diese Lösung haben?
Um den pH-Wert der Lösung aus der Hydroniumkonzentration (H+), 2.10-4 mol/L müssen wir den folgenden Ausdruck verwenden:
pH = -log[H+]
pH = -log[2,10-4 ]
pH = –(log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 – 4.log 10
pH = –0,3 + 4,(1)
pH = -0,3 + 4
pH = 3,7
2. Beispiel: Eine Lösung, die von einem bestimmten gelösten Stoff gebildet wird, hat eine Hydroxidionenkonzentration von 10-11 mol/l. Aus dieser Konzentration können wir sagen, dass der pH-Wert dieser Lösung wie viel wert ist?
Um den pH-Wert der Lösung aus der Hydroxidkonzentration zu bestimmen, 10-11 mol/L müssen wir Folgendes tun:
1Ö Schritt: Berechne den pOH-Wert.
10-pOH = [OH-]
10-pOH = 10-11
Wir müssen den Ausdruck mit -1 multiplizieren, da pOH immer eine positive Unbekannte ist.
-pOH = -11.(-1)
pOH = 11
2Ö Schritt: Berechne den pH-Wert.
pH + pOH = 14
pH + 11 = 14 =
pH = 14 - 11
pH = 3
Von mir. Diogo Lopes Dias
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
TAGE, Diogo Lopes. "Was ist pH?"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm. Zugriff am 27. Juni 2021.
Chemie
Hydroxyapatit-Mineral, Mund-pH, Karies, Zahnkorrosion, regelmäßige Anwendung von Fluorid, Mundgesundheit, o Rauchen und Zähne, Zahnflecken, Lippenkrebs, Salzsäure, Bulimie, Milchsäure, Bims, Sil