Die Hydrierung erfolgt mit ungesättigten acyclischen Kohlenwasserstoffen, die offene Ketten mit Doppel- oder Dreifachbindungen aufweisen, wie Alkene, Alkine und Diene. Es kann auch bei aromatischen Kohlenwasserstoffen vorkommen, da diese Doppelbindungen im Ring aufweisen, und bei Cyclanen (Cycloalkanen) mit bis zu fünf Kohlenstoffatomen.
Diese Verbindungen reagieren wie Wasserstoffgas in Gegenwart einiger Katalysatoren, wie Nickel, Platin und Palladium, unter Erhitzen. So kommt es zu einer Additionsreaktion, bei der die pi(π)-Bindung aufgebrochen wird, zwei neue Einfachbindungen entstehen und Wasserstoff in das Molekül eingeführt wird.
Generell haben wir:
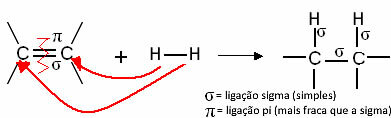
Generische Hydrierungsreaktion
Schauen wir uns nun einige Beispiele an:
- Hydrierung zu Alkenen: Das erhaltene Produkt ist ein Alkan.
Unten haben wir eine Hydrierungsreaktion von Ethylen (oder Ethylen), um Ethan zu erhalten:
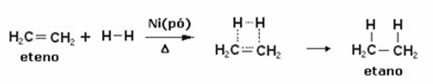
Beispiel einer Ethylenhydrierungsreaktion
Diese Art der katalytischen Hydrierung wird von der Lebensmittelindustrie zur Herstellung halbfester Fette wie z
Margarinen. Pflanzenöle und -fette unterscheiden sich nur dadurch, dass Öle lange Moleküle haben mit Doppelbindungen zwischen den Kohlenstoffen, während Fette nur Einfachbindungen zwischen ihren Kohlenstoffe.Um ein Öl in ein Fett umzuwandeln, reicht es also aus, das Öl zu hydrieren. Auf diese Weise werden Ihre Doppelbindungen gebrochen und in Einfachbindungen umgewandelt. Das Ergebnis ist die Produktion von Anrufen gehärtete Pflanzenfette.
- Alkinhydrierung: Da Alkine zwei pi-Bindungen aufweisen, erfolgt ihre vollständige Hydrierung in zwei Stufen, wobei im ersten ein Alken und im zweiten ein Alkan gebildet wird.
In der folgenden Reaktion haben wir die Hydrierung von Propin mit abschließender Bildung von Propan:
1. Schritt: H3C C ≡ CH+ H2 → H3C CH═ ÇH2
2. Stufe: H3C CH═ ÇH2 + 2 Stunden2 → H3C CH2─ ÇH3
Wenn wir möchten, dass diese Reaktion im ersten Schritt stoppt, müssen wir eine Substanz verwenden, die die Wirkung des Katalysators stoppt.
- Hydrierung von Dienen: Es gibt drei Arten von Dienen: angesammelt (Doppelbindungen erscheinen unten), isoliert (Doppelbindungen sind durch mindestens zwei Einfachbindungen getrennt) und konjugiert (Doppelbindungen erscheinen abwechselnd).
Die Hydrierung der akkumulierten und isolierten Diene erfolgt in gleicher Weise wie bei den Alkenen, jedoch doppelt, da die Diene mehr Ungesättigtheit aufweisen. Siehe zwei Beispiele:
* Beispiel einer Hydrierung in akkumuliertem Dien:
H H H
│ │ │
H3C CH ═ Ç ═ CH CH3 + 2 Stunden2 → H3C CH ─ Ç ─ CH CH3
│ │ │
H H H
* Beispiel einer Hydrierung in isoliertem Dien:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 CH ═ CH CH3 +2 H2 → H3C CH ─ CH─CH2 CH ─ CH CH3
Andererseits kann die Hydrierung von konjugierten Dienen auf zwei Arten erfolgen: mit 1,2-Addition und 1,4-Addition. Am gebräuchlichsten ist die 1,2-Addition, bei der Wasserstoff an Kohlenstoffe, die die Doppelbindung bilden, und bei niedrigen Temperaturen angelagert wird. Die 1,4-Addition erfolgt dagegen bei erhöhten Temperaturen und tritt auf, wenn Resonanz und das Auftreten von freien Valenzen in den Kohlenstoffen 1 und 4 auftritt. Siehe Beispiele für jeden Fall:
* Beispiel für 1,2-Addition in konjugierten Dienen:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* Beispiel für 1,4-Addition in konjugierten Dienen:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Hydrierung von Aromaten: Die Pi-Bindungen des Benzolrings werden aufgebrochen und die Wasserstoffatome werden an die Kohlenstoffe addiert, die diese Bindungen bilden.
Diese Art der Gesamthydrierung ist unten dargestellt:

Gesamt-Benzol-Hydrierungsreaktion
- Cyclanhydrierung: Bildung eines Alkans tritt auf.
Beispiel: Hydrierung von Cyclopropan:
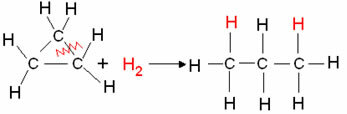
Cyclopropan-Hydrierungsreaktion
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm
