Enzyme sind biologische Katalysatoren, die für die Beschleunigung einer bestimmten chemischen Reaktion verantwortlich sind. Enzyme sind normalerweise Proteine, aber es gibt einige Ribonukleinsäuren die als Enzyme fungieren und Ribozyme genannt werden.
Um eine Reaktion zu beschleunigen, müssen Enzyme an Reagenzien, sogenannte Substrate, binden. Lange Zeit glaubte man, dass diese Verbindung auf sehr starre Weise erfolgt, ein Muster, das als Schlüsselschloss bekannt ist. im Augenblick, Jedoch, das als induzierte Anpassung bekannte Modell wird akzeptiert., die davon ausgeht, dass sich die Form des Enzyms beim Eintritt des Substrats in das aktive Zentrum geringfügig ändert.
Lesen Sie auch: Was ist Stoffwechsel?
Was sind Enzyme?
Enzyme sind Biomoleküle, die als Katalysatoren wirken, das heißt, sie sind Stoffe, die die Geschwindigkeit von chemische Reaktionen die in Lebewesen vorkommen, ohne während dieser Reaktionen verbraucht zu werden. Ohne die Wirkung von Enzymen würden manche Reaktionen sehr langsam ablaufen, was den Stoffwechsel schädigen würde. Enzyme beschleunigen selektiv Reaktionen und sind daher sehr spezifische Katalysatoren.
Enzyme sind in der Lage, eine Reaktion zu beschleunigen, indem sie die Aktivierungsenergie herabsetzen, dh sie reduzieren die Energiemenge, die zum Starten einer Reaktion zugeführt werden muss.
[publication_omnia]
Ist jedes Enzym ein Protein?
Obwohl sie oft als biologische Katalysatoren mit Proteincharakter definiert werden, nicht jedes Enzym ist ein Protein. Es gibt einige RNAs, die wie Enzyme funktionieren, die Ribozyme genannt werden. Die meisten Enzyme sind jedoch Proteine und werden daher von Aminosäuren. Die Aminosäurezusammensetzung dieser Biomoleküle definiert die dreidimensionale Struktur, die sie erhalten.
Lesen Sie auch: Wie wirken Katalysatorsubstanzen?
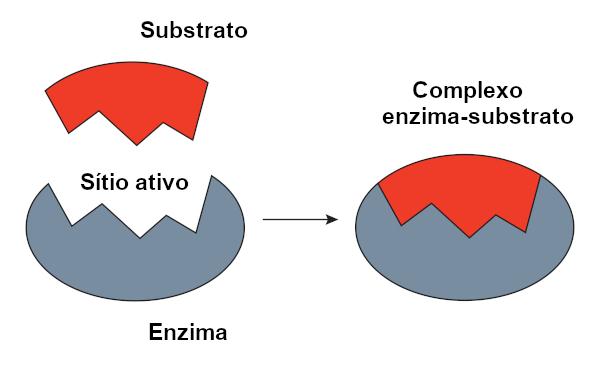
Enzym-Substrat-Komplex
Es wird als Reagenzsubstrat bezeichnet, auf das ein Enzym einwirkt. Wenn ein Enzym an sein Substrat bindet, bildet sich der Komplex Enzym-Substrat. Diese Bindung findet in einer bestimmten Region statt, die als aktives Zentrum bezeichnet wird.
Wenn wir von proteinbasierten Enzymen sprechen, entspricht das aktive Zentrum nur wenigen Aminosäuren, während der Rest des Moleküls für die Bestimmung der Konfiguration des aktiven Zentrums verantwortlich ist. Die Form des aktiven Zentrums sowie die Form des Substrats hängen von der Spezifität des Enzyms ab, da sie komplementär sein müssen.
Modell mit Tastensperre
Ö Schlüsselschloss-Modell, vorgeschlagen von Emil Fischer, wird häufig verwendet, um die Interaktion zwischen Enzym und Substrat zu erklären. Nach diesem Modell besteht zwischen dem Enzym und dem Substrat eine starre Komplementarität, genau wie bei einem Schlüssel und einem Schloss. Das aktive Zentrum des Enzyms hätte eine komplementäre Form zum Substrat, die perfekt passen würde. Andere Moleküle hätten daher keinen Zugang zu dieser Stelle, was die Spezifität des Enzyms garantieren würde. So wie ein Schlüssel nur ein Schloss öffnet, würde ein Enzym nur an ein Substrat binden. Heute wissen wir jedoch, dass dies Modell ist nicht korrekt, da Enzyme keine starren Strukturen sind, wie bisher angenommen.
Induziertes Anpassungsmodell
Derzeit ist die das am meisten akzeptierte Modell zur Erklärung der Verbindung zwischen einem Enzym und seinem Substrat ist der von schnappen induziert, ursprünglich vorgeschlagen von Koshland et al. Das aktive Zentrum und das Substrat arbeiten nicht starr wie ein Schlüssel und ein Schloss. Untersuchungen haben gezeigt, dass das Enzym beim Eintritt des Substrats in das aktive Zentrum eine leichte Modifikation erfährt, die die Anpassung zwischen dem aktiven Zentrum und dem Substrat begünstigt. Um dieses Modell besser zu verstehen, können wir uns die Enzym-Substrat-Interaktion als Handschlag vorstellen, der nach dem ersten Kontakt fester wird.
Cofaktoren
Die meisten Enzyme benötigen für ihre katalytische Wirkung Hilfsmoleküle, sogenannte Cofaktoren. Cofaktoren können permanent an das Enzym oder schwach und reversibel an das Substrat gebunden sein. Sie auch kann anorganisch oder organisch sein. Wenn Cofaktoren organische Moleküle sind, heißen sie Coenzyme.
Etwas Vitamine fungieren als Coenzyme, dies ist beispielsweise bei Riboflavin, auch als Vitamin B2 bekannt, der Fall. Als Beispiele für anorganische Cofaktoren können wir Eisen und Zink in ihrer ionischen Form nennen.
Lesen Sie auch: Vitamine des B-Komplexes – eine Gruppe von Vitaminen, die im Allgemeinen als Coenzyme wirken
Enzymklassifizierung
Enzyme lassen sich einteilen in sechs Gruppen, wobei als Kriterium die Art der Reaktion verwendet wird, die sie katalysieren.
Oxidoreduktasen: Enzyme, die mit den Reaktionen von oxyrdie Ermäßigung.
Transferasen: katalysieren die Übertragung von Gruppen von einer Verbindung auf eine andere.
Hydrolasen: Hydrolysereaktionen katalysieren.
Verbindungen: wirken durch Hinzufügen von Gruppen zu Doppelbindungen oder Entfernen von Gruppen, die eine Doppelbindung bilden.
Isomerasen: katalysieren Isomerisierungsreaktionen.
Links: Enzyme, die den Abbau des Moleküls von ATP, die bei dieser Reaktion freigesetzte Energie nutzt, um neue Verbindungen zu bilden.
Faktoren, die die Enzymaktivität regulieren
Die Aktivität eines Enzyms wird von Faktoren beeinflusst, vor allem von der Temperatur und der pH. Die Temperatur spielt bei chemischen Reaktionen im Allgemeinen eine positive Rolle, da sie die Geschwindigkeit einer enzymatischen Reaktion erhöht. Wenn jedoch die Temperatur über die optimalen Bedingungen hinaus ansteigt, sinkt die Reaktionsgeschwindigkeit erheblich. Dies liegt daran, dass die Denaturierung von Proteinen beobachtet wird. Die meisten menschlichen Enzyme haben eine optimale Temperatur zwischen 35 und 40 ºC. Neben der Temperatur ist die pH es beeinflusst auch die enzymatische Aktivität, und es gibt auch einen optimalen Wert. Für die meisten Enzyme liegt der optimale pH-Wert im Bereich von 6 bis 8.
Von Vanessa Sardinha dos Santos
Biologie Lehrer
