Zum klassifizieren einen Sigma-Link, es ist wichtig zu wissen, wie man es in der Struktur eines Moleküls erkennt. Die Sigma-Bindung ist eigentlich eine kovalente Bindung, die tritt auf, wenn zwei unvollständige Atomorbitale (mit nur einem Elektron) sich auf der gleichen Achse durchdringen. Ein Beispiel ist, wenn ein Orbital vom p-Typ (Helix) mit einem anderen p-Orbital durchdringt.

p-Orbitale, die sich in einer p-p-Sigma-Bindung durchdringen
In der Praxis (bei Übungen), die Erkennung und Klassifizierung eines Sigma-Links erfolgt anhand der Strukturformel eines Stoffes, wie in der folgenden Strukturdarstellung:

Strukturformel von Blausäure
Bevor Sie einen Sigma-Link klassifizieren, man muss wissen, wie man es in einer Strukturformel erkennt. Denken Sie dazu einfach an die Wege wie a kovalente Bindung wird repräsentiert: der Anruf einfach wird durch einen einzelnen Bindestrich (-) dargestellt, der Paar wird durch zwei (=) und den Link dargestellt verdreifachen wird durch drei (≡) dargestellt. Die Sigma-Bindung ist in jeder der drei Darstellungen kovalenter Bindungen wie folgt vorhanden:
Einfach: hat eine Sigma-Anleihe;
Paar: Von den beiden Links ist nur einer Sigma;
Verdreifachen: Einer der drei Links ist Sigma.
Wenn Sie wissen, wie Sie einen Sigma-Link erkennen, müssen Sie im nächsten Schritt lernen, wie man ihn einordnet. Dazu müssen wir das unvollständige Orbital jedes an der Bindung beteiligten Atoms kennen:
H - stellt das unvollständige s-Orbital dar, daher wird es in der Klassifikation durch s dargestellt.
Ametalle- ein unvollständiges p-Orbital haben, daher werden sie in der Klassifikation durch p dargestellt, mit Ausnahme der folgenden Elemente:
Kohlenstoff: Ihr unvollständiges Orbital hängt von der Art des Hybridisierung dass er leidet. Die Möglichkeiten sind: sp-Hybridisierung3 (Wie viel kostet es vier einfache Anrufe), sp2 (wie viel macht es zwei Einfach- und eine Doppelbindung) oder sp (wie viel es zwei Doppelbindungen oder eine Einfach- und eine Dreifachbindung ausführt). Somit kann Kohlenstoff in der Klassifikation einer Sigma-Bindung durch sp. dargestellt werden3, sp2 oder sp, je nachdem, welchen Anruf Sie tätigen.
Beryllium:leiden sp-Typ-Hybridisierung, wird also in der Klassifikation durch sp repräsentiert.
Bor:leiden sp-Typ-Hybridisierung2, daher wird es in der Klassifikation durch sp repräsentiert.2.
Mit all diesen Informationen ist es am einfachsten, die in einer Struktur vorhandenen Sigma-Links zu klassifizieren. Sehen wir uns einige Beispiele an:
Beispiel 1: Sigma-Anschlüsse im Wasser

Strukturformel von Wasser
Die obige Strukturformel zeigt, dass Wasser zwei Sigma-Anleihen (zwei einfache), sind sie zwischen dem Sauerstoff (dargestellt durch p) es ist das Wasserstoff (vertreten durch s). Daher haben wir zwei Sigma-Links, die unterteilt sind in:
s-p
Beispiel 2: Sigma-Bindungen in Phosphortrichlorid

Strukturformel von Phosphortrichlorid
Die obige Strukturformel zeigt, dass Phosphortrichlorid drei Anrufesigmas (drei einfach), sind sie Betreten Sie den Phosphor (dargestellt durch p) es ist das Chlor (dargestellt durch p). Daher haben wir drei Sigma-Links, die unterteilt sind in:
p-p
Beispiel 3: Sigma-Bindungen in Bortrifluorid
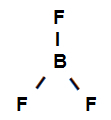
Strukturformel von Bortrifluorid
Die obige Strukturformel zeigt, dass Bortrifluorid drei Sigma-Links (drei einfach), sind sie Geben Sie das Bor ein (vertreten durch sp2) es ist das Fluor (dargestellt durch p). Daher haben wir drei Sigma-Links, die unterteilt sind in:
p-sp2
Beispiel 4: Sigma-Bindungen in Ethanol
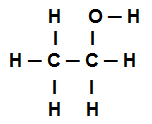
Strukturformel von Ethanol
Die obige Strukturformel für Ethanol zeigt, dass Wir haben die Anwesenheit von acht Anrufen Sigmas (acht einfache Links). Sind sie:
Einer unter den Sauerstoff (dargestellt durch p) und der Wasserstoff (vertreten durch s). Somit wird der Link in Sigma s-p klassifiziert.
Einer von zwei Kohlen die nur Sigma-Verbindungen durchführen (und dann vertreten durch sp3). Somit wird der Link klassifiziert in sp3-P3.
Einer unter den Carbon (vertreten durch sp3) und der Sauerstoff (dargestellt durch p). Somit wird der Sigma-Link klassifiziert in p-sp3.
fünf zwischen Kohlenstoff (vertreten durch sp3) und der Wasserstoff (vertreten durch s). Somit werden alle fünf klassifiziert in s-sp3.
Beispiel 5: Sigma-Bindungen in Dichlorethen

Dichlorethen-Strukturformel
Die obige Strukturformel von Dichlorethen zeigt, dass wir die Anwesenheit von Fünf Sigma-Links (die vier Einfachbindungen und eine der Doppelbindungen). Sind sie:
Einer von zwei Kohlen die zwei Einfach- und eine Doppelbindung ausführen (und dann vertreten durch sp2). Somit wird der Sigma-Link klassifiziert in sp2-P2.
Vier liegen zwischen Kohlenstoff(vertreten durch sp2)und der Wasserstoff (dargestellt durch s). Somit werden alle vier klassifiziert in s-sp2.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm

