DAS Winkelgeometrie ist eine von mehreren Arten von Molekulargeometrie, die noch linear, pyramidal, flach trigonal sein kann, tetraedrisch, usw. Winkelgeometrie kann nur in Molekülen gefunden werden, die die folgenden Eigenschaften aufweisen:
Triatomics, das heißt, sie haben nur drei Atome;
Mindestens drei Elektronenwolken im Zentralatom haben.
Hinweis: elektronische Cloud ist alles kovalente Bindung (einfach, doppelt, dreifach oder koordiniert) zwischen Atomen und Elektronenpaaren der pair Valenzschicht die nicht an einem Anruf teilnehmen.
Sehen Sie sich einige Beispiele für Moleküle mit eckiger Geometrie an:
1. Beispiel: Wasser (H2Ö)

konventionelle Wasserstruktur
In der Struktur des Wassers haben wir:
Drei Atome: zwei Wasserstoffe und ein Sauerstoff;
Sauerstoff ist das Zentralatom, weil es eine größere Anzahl von Bindungen eingeht (zwei, da es zur VIA-Familie gehört);
Zwei Einfachbindungen zwischen Sauerstoff und Wasserstoff. Dies liegt daran, dass jeder Wasserstoff nur eine Bindung eingehen kann und Sauerstoff zwei Bindungen;
Vier nichtbindende Elektronen im Sauerstoff, da er sechs Elektronen in der Valenzschale hat und nur zwei in den Bindungen verwendet.
Daher gibt es, wie im Wassermolekül, im Zentralatom drei Atome und vier Elektronenwolken (zwei Einfachbindungen und zwei Paare nichtbindender Elektronen). Geometrie ist eckig.
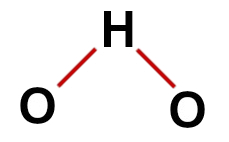
Richtige Strukturformel von Wasser
Hinweis: Immer wenn das Molekül diese Muster aufweist, beträgt der zwischen den Atomen gebildete Winkel ungefähr 109º 28'.
2. Beispiel: Schwefeldioxid (SO2)

Konventionelle Struktur von Schwefeldioxid
In der Struktur von Schwefeldioxid haben wir:
Drei Atome: zwei Sauerstoff- und ein Schwefelatom;
Schwefel ist das Zentralatom, da es das kleinste Element im Molekül ist, da alle Elemente die gleiche Anzahl von Bindungen eingehen müssen (zwei);
Eine Doppelbindung zwischen Schwefel und einem der Sauerstoffe. Das liegt daran, dass beide zwei Verbindungen benötigen;
Einer koordinative oder dative kovalente Bindung, weil der Schwefel nach der Paarung mit dem anderen Sauerstoff stabil war, aber es gibt immer noch ein Sauerstoffatom, das zwei Elektronen benötigt;
Vier nicht bindende Elektronen im Sauerstoff. Das liegt daran, dass Sauerstoff sechs Elektronen in der Valenzschale hat und nur zwei in den Bindungen verwendet.
So wie im Schwefeldioxid-Molekül gibt es im Zentralatom drei Atome und vier Elektronenwolken (zwei Einfachbindungen und zwei nichtbindende Elektronenpaare). Geometrie ist eckig.
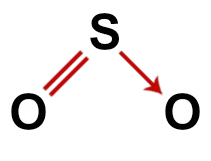
Korrekte Strukturformel von Schwefeldioxid
Hinweis: Wenn das Molekül diese Muster aufweist, beträgt der zwischen den Atomen gebildete Winkel ungefähr 120Ö.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm

