Eine der größten Herausforderungen für jeden, der Chemie lernt, heißt elektronische Verteilung. Was wir in diesem Zusammenhang präsentieren werden, kann Ihre Studien im Zusammenhang mit der vom Wissenschaftler Linus Pauling vorgeschlagenen Elektronenkonfiguration erheblich erleichtern.
Die maximale Anzahl von Elektronen, die in jede Schicht oder jedes Energieniveau passt, ist in der Tabelle angegeben:
Energieniveau Schicht Maximale Anzahl von Elektronen
1. K 2
2. L 8
3. M 18
4. N 32
5° O 32
6. P 18
7. Q 8
Die aufsteigende Energieordnung der Unterniveaus ist die Ordnung in der Reihenfolge der Diagonalen. Das Linus-Pauling-Diagramm ist unten dargestellt:
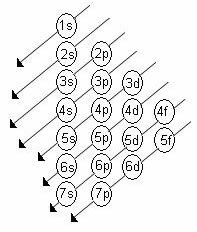
Grundregeln:
1. Die Ordnungszahl (Z) des Elements im neutralen Zustand gibt die Anzahl der zu verteilenden Elektronen an. Diese Zahl wird im unteren linken Teil des Elementsymbols dargestellt.
2. Beginnen Sie mit dem Pauling-Diagramm, die Elektronen von oben nach unten zu verteilen, und berücksichtigen Sie dabei die aufsteigende Energieordnung (orientiert an der Richtung der Pfeile).
3. Füllen Sie die Unterniveaus mit dem maximalen Elektronenniveau. Wenn eine bestimmte Unterebene nur 6 Elektronen enthält, überschreiten Sie diese Menge nicht.
4. Überprüfen Sie die Anzahl der Elektronen, indem Sie sie in jeder Unterebene addieren.
Setzen wir es in die Tat um?
Verteilen Sie die Elektronen des Eisenatoms (Z=26).
Wenn die Ordnungszahl 26 ist, bedeutet dies, dass das normale Eisenatom 26 Elektronen enthält. Wenn wir das Pauling-Diagramm anwenden, erhalten wir:

Von Líria Alves
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm

