Es gibt drei Arten von Alkadienen oder Dienen, die sind:
1-Kumuliert: Die Doppelbindungen befinden sich am gleichen Kohlenstoff und treten nacheinander auf:
C ═ Ç ═ C
│ │
2- Isoliert: Die Doppelbindungen befinden sich an verschiedenen Kohlenstoffen und sind durch mindestens zwei aufeinanderfolgende Einfachbindungen getrennt:
│
C ═ C C ─ C ═ C
│ │ │ │ │
3- Konjugate: Doppelbindungen treten abwechselnd auf und sind durch eine einzelne Einfachbindung getrennt:
C ═ C C ═ C
│ │ │ │
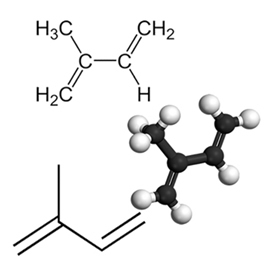
Ein Beispiel für ein wichtiges konjugiertes Dien ist Isopren, eine Grundeinheit der Terpengruppe, einer Klasse organischer Verbindungen. sehr wichtig, einige Beispiele für Produkte, die von Isoprenen gebildet werden, sind Kautschuk, Beta-Carotin (verantwortlich für die orange Farbe des Karotten), Vitamin A und Öle in Fruchtschalen, Samen, Blüten, Blättern, Wurzeln, Gemüse und Holz, wie Limonen undli Myrcen.
Zum akkumulierte und isolierte Diene, Additionsreaktionen treten auf genau wie bei Alkenen, was Sie beim Lesen des Textes verstehen können reading
Additionsreaktionen. Der einzige Unterschied besteht darin, dass Diene diese Art von Doppelreaktion eingehen, weil sie zwei Doppelbindungen haben, während Alkene nur eine Doppelbindung haben.Im Fall von konjugierte Diene, die Additionsreaktion hat eine Besonderheit, da diese Verbindungen in Resonanz gehen können, sodass die Addition auf zwei Arten erfolgen kann:
1- Zusatz 1.2:
Dies wird als normale Addition angesehen, da die Addition an den beiden Kohlenstoffatomen erfolgt, die dieselbe Doppelbindung eingehen, d. h. an den Kohlenstoffatomen 1 und 2:
H2Ç ═ CH─ CH ═ CH2 + HBr → H2C CH─ CH ═ CH2
│ │
HBr
Beachten Sie, dass diese Art von Reaktion der Markownikows Regel, der Wasserstoff bindet an den stärker hydrierten Kohlenstoff (mit mehr angehängten Wasserstoffatomen).
Addition 1,2 wird bei niedrigen Temperaturen (-60°C) verarbeitet.
2- Zusatz 1.4:
In diesem Fall läuft die Reaktion bei hohen Temperaturen ab. Es ist wichtig darauf hinzuweisen, dass immer sowohl das Produkt der Zugabe von 1,2 als auch das der Zugabe von 1,4 gebildet wird, aber die Temperatur zeigt an, welche Menge in größerer Menge gebildet wird.
Das Folgende ist ein Beispiel für die Hinzufügung des Typs 1.4:
H2Ç ═ CH─ CH ═ CH2 + HBr → H2C CH ═ CH─CH2
│ │
HBr
Beachten Sie, dass Folgendes geschieht: eines der gemeinsamen Elektronen in der Pi-Bindung jedes der Doppelkohlenstoffe werden mit dem Substituenten geteilt und die anderen bilden eine neue Doppelbindung zwischen anderen Kohlenstoffen:
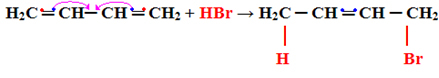
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm