Der amerikanische Chemiker Gilbert N. Lewis (1875-1946) schlug die Oktettregel vor, die besagt:
"Atome verschiedener Elemente bauen chemische Bindungen auf, indem sie Elektronen spenden, aufnehmen oder teilen, um die elektronische Konfiguration von zu erhalten Edelgas, also mit 8 Elektronen in der letzten Schale (bzw. mit 2 Elektronen bei den Atomen, die nur eine Elektronenschale haben, wie es beim Wasserstoff)."
Im Jahr 1916 schlug Lewis vor, stabil zu bleiben und das Oktett oder Duett zu erreichen, die Elemente, aus denen die molekulare Substanzen Elektronenpaar-Sharing durchführen. Diese Stoffe werden nur von Atomen von. gebildet Wasserstoff, Nichtmetalle und Halbmetalle, alles mit dem Tendenz zur Aufnahme von Elektronen. Daher gibt es für keinen von ihnen die Möglichkeit, ein Elektron abzugeben (wie es bei Metallen in ionischen Bindungen der Fall ist), aber jeder muss empfangen, also teilen sie ihre Elektronen durch eine kovalente Bindung oder molekular.
Daher schlug Gilbert Lewis eine Möglichkeit vor, die kovalente oder molekulare Bindung darzustellen, die als. bekannt wurde
Lewis-Formel. Sie heißt auch elektronische Formel oder doch, Lewis' elektronische Formel, denn sein Hauptmerkmal ist, dass es zeigt die Elektronen in der Valenzschale jedes Atoms und die Bildung von Elektronenpaaren.Jedes Elektron wird durch einen Punkt dargestellt., die das Symbol des entsprechenden chemischen Elements umgibt. Nur die Valenzschalenelektronen sind um das Element herum.
Wie in der folgenden Tabelle gezeigt, um die Anzahl der Elektronen in der Valenzschale zu kennen, kennen Sie einfach die Familie des Periodensystems:

In der Lewis-Formel jedes gemeinsame Elektronenpaar repräsentiert eine chemische (kovalente) Bindung, wo sich die Elektronen im Bereich der Elektrosphäre treffen, der jedem Paar von miteinander verbundenen Atomen gemeinsam ist. Daher werden sie in der Darstellung nebeneinander platziert.
Lassen Sie uns zum Beispiel die Lewis-Formel für Wasserstoffgas herausfinden, deren Summenformel lautet: H is2.
Jedes Wasserstoffatom hat nur ein Elektron in der Valenzschale, da dieses Element zur Familie 1 des Periodensystems gehört. Jedes muss ein weiteres Elektron erhalten, um stabil zu sein, mit zwei Elektronen in der K-Elektronenschale. Sie teilen sich also ihre Elektronen und bekommen beide zwei. Aussehen:
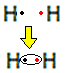
Dies ist die Lewis-Formel für das Wasserstoffgasmolekül.
Sauerstoff hat sechs Elektronen in seiner Elektronenhülle, daher muss jeder mit acht Elektronen zwei weitere Elektronen aufnehmen, um stabil zu sein. Daher lautet die Lewis-Formel für das Sauerstoffgasmolekül:

Beachten Sie, dass es zwei Links gibt, da es zwei gemeinsame Paare gibt.
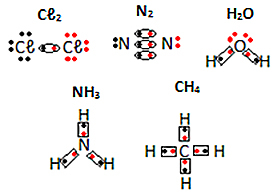
Weitere Beispiele für elektronische Formeln molekularer Substanzen finden Sie unten:
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm