Einer Oxidationsreaktion in organischen Verbindungen tritt auf, wenn a Sauerstoffeinlass (oder Wasserstoffausstoß) im organischen Molekül.
| Einer milde Oxidation kommt nur in Kohlenwasserstoffen mit Ungesättigtheit, d. h. mit Doppel- (Alkene) oder Dreifachbindungen (Alkin). |
Damit gesättigte Kohlenwasserstoffe oxidieren, ist eine energiereichere Oxidation erforderlich.
Milde Oxidation nutzt die Baeyer reaktiv, die einer wässrigen Lösung von Kaliumpermanganat (KMnO4) in einem neutralen oder schwach alkalischen (basisch – OH1-), kalten Medium entspricht. Dieses Reaktiv wird so genannt, weil der deutsche Chemiker Adolf von Baeyer einen Test vorgeschlagen hat, der als Baeyers Test, um Alkene und ihre Cyclanisomere zu identifizieren.
Dieser Test funktioniert wie folgt: Wie wir später sehen werden, reagiert ein Alken mit dem Permanganat von Kalium, dadurch wird seine Farbe, zunächst violett, farblos und es entsteht ein Niederschlag braun (MnO2). Cyclane reagieren jedoch nicht mit Kaliumpermanganat. Bleibt die Lösung also violett, handelt es sich um einen Cyclan.
Die Abbildung unten zeigt, dass der Test nur im linken Reagenzglas auf Alkene positiv war, da der braune Niederschlag erschien.

Die Oxidationsreaktion von Alkenen beginnt mit der Zersetzung des Permanganats unter Bildung von Sauerstoff:
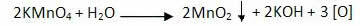
Milde Oxidation von Alkenen:
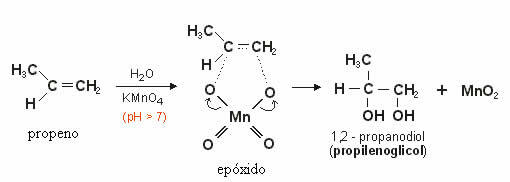
Dieser erzeugte Sauerstoff reagiert mit der Doppelbindung des Alkens und bildet a Epoxid die später durch Hydrolyse zu a Alkohol oder vicinales Diol (Glykol), also zwei OH-Gruppen an benachbarten Kohlenstoffen.
Im folgenden Beispiel sehen wir die milde Oxidation von Propen:
Milde Oxidation von Alkinen:
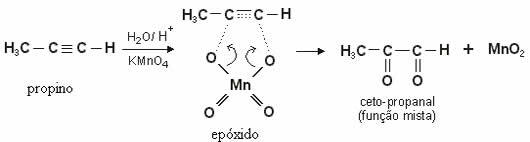
Im Falle von Alkine, das gebildete Produkt ist diketone. Mit Ausnahme der Ethin (HC≡CH), wobei an jedem Kohlenstoff, der an der Dreifachbindung beteiligt ist, zwei Wasserstoffe gebunden sind, a Aldehyd.
Beachten Sie die milde Oxidation von Propin unter Bildung eines Diketons:
Von Jennifer Fogaça
Abschluss in Chemie
Brasilianisches Schulteam
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/oxidacao-branda.htm
