Da es Tausende organischer Verbindungen gibt, kann das Phänomen der Isomerie verschiedene Formen annehmen. Daher kann die Isomerie grundsätzlich in zwei Typen eingeteilt werden: flache oder konstitutionelle Isomerie und Raumisomerie oder Stereoisomerie. Jeder erwähnte Typ kann unterteilt werden, wie in der folgenden Abbildung dargestellt:
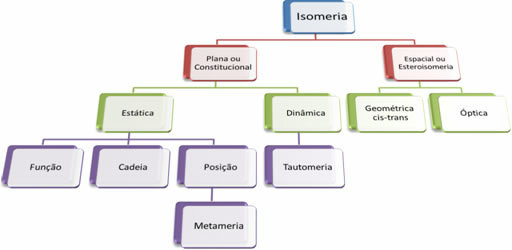
Siehe jeden Fall:
1. Flache oder konstitutionelle Isomerie: Derartige Isomere haben die gleiche Summenformel und zeichnen sich durch flache Strukturformeln aus. Es gibt fünf Fälle von Ebenenisomerie: Funktion, Kette, Position, Metamerie und Tautomerie.
1.1.Funktionelle oder funktionelle Isomerie: Der Unterschied zwischen den Isomeren liegt in der funktionellen Gruppe.
Beispiel: Summenformel C3H6Ö
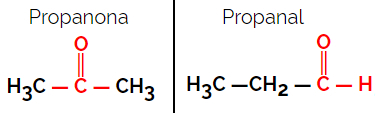
Beachten Sie, dass Propanon aus der Ketongruppe und Propanal aus der Aldehydgruppe stammt.
1.2. Ketten- oder Skelettisomere: Der Unterschied zwischen den Isomeren liegt in der Art der Kette. Beispielsweise ist ein Isomer offenkettig und das andere geschlossenkettig, oder eines ist normalkettig und das andere verzweigtkettig, oder eines ist eine homogene Kette und das andere ist eine heterogene Kette.
Beispiel: Summenformel C4H10
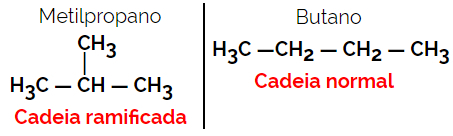
1.3.Positions- oder Positionsisomerie: Der Unterschied liegt in der Position einer Ungesättigtheit, einer funktionellen Gruppe, eines Heteroatoms oder eines Substituenten.
Beispiel: Summenformel C4H6

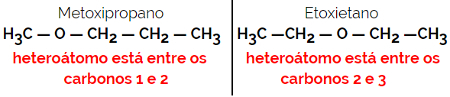
1.4.Kompensationsisomerie oder Metamerie: Es handelt sich um eine spezielle Art der Positionsisomerie, bei der der Unterschied in der Position des Heteroatoms liegt.
Beispiel: Summenformel C4H10Ö
1.5.Dynamische Isomerie oder Tautomerie: Es handelt sich um eine spezielle Art der Funktionsisomerie, bei der die Isomere in Lösung im dynamischen Gleichgewicht koexistieren. Die beiden Haupttypen von Tautomerie liegen zwischen einem Keton und einem Enol (Ketoenol-Gleichgewicht) und zwischen einem Aldehyd und einem Enol (Aldoenol-Gleichgewicht).
Beispiel: Summenformel C3H6Ö
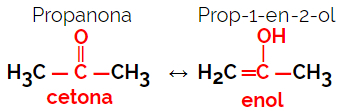
2. Weltraumisomerie oder Stereoisomerie: In diesem Fall kann der Unterschied zwischen den Isomeren nur durch die Orientierung ihrer Atome im Raum sichtbar gemacht werden. Es gibt zwei Arten von Stereoisomerie: geometrische Isomerie und optische Isomerie.
2.1.Geometrische oder cis-trans-Isomere: Der Unterschied besteht darin, dass das Isomer mit dem Namen cis es hat die gleichen Kohlenstoffliganden in einer Doppelbindung oder in cyclischen Verbindungen auf derselben Seite der Ebene. Die isomeren Liganden trans sind auf gegenüberliegenden Seiten.
Beispiel: Summenformel C2H2Cl2

Diese Verbindungen heißen Stereoisomere.
2.2.Optisches Isomer: Tritt auf, wenn Isomere in der Lage sind, einen polarisierten Lichtstrahl abzulenken. Krümmt es den polarisierten Lichtstrahl nach links, ist es ein linksdrehendes Isomer, biegt es nach rechts, so spricht man von einem rechtshändigen Isomer.
Beispiel:
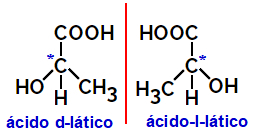
Asymmetrische Moleküle wie die oben gezeigten, die spiegelbildlich zueinander sind und nicht überlagert werden können, heißen Enantiomere.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm



