DAS Kohlenstoffhybridisierung vom sp-Typ es passiert nur, wenn es zwei Pi-Bindungen (π) und zwei Sigma-Bindungen (σ) bildet. In diesem Fall gibt es also zwei Möglichkeiten: Kohlenstoff kann zwei Doppelbindungen oder eine Einfach- und eine Dreifachbindung eingehen, wie unten gezeigt:
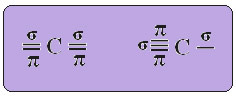
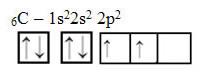
Der Text "sp-Typ-Hybridisierung3“ zeigt im Detail, wie die Kohlenstoffhybridisierung abläuft. Zur Erinnerung: Hybridisierung ist das „Vermischen“ reiner Atomorbitale, die hybride Atomorbitale erzeugen, die einander äquivalent sind, sich aber von den ursprünglichen reinen Orbitalen unterscheiden. Dies geschieht also in den Kohlenstofforbitalen, die ursprünglich so dargestellt wurden:
Bei Energieaufnahme wird jedoch ein Elektron (dargestellt durch einen Pfeil) aus dem 2s-Orbital in das 2p-Orbital befördert:
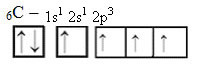
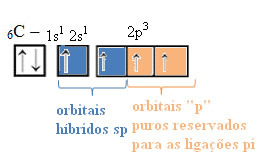
Auf diese Weise hat der Kohlenstoff vier ungepaarte Orbitale und kann vier kovalente Bindungen eingehen, nicht nur zwei.
Im Fall einer Hybridisierung vom sp-Typ wissen wir, dass zwei Bindungen pi sein werden; diese treten in den reinen „p“-Orbitalen auf, während die anderen beiden Orbitale, die sp-Hybride sind, die verbleibenden Sigma-Bindungen eingehen.
Die räumliche Darstellung dieser Hybridisierung zwischen einem s- und einem p-Orbital, die zu einem hybriden sp-Orbital führt, kann wie folgt dargestellt werden:
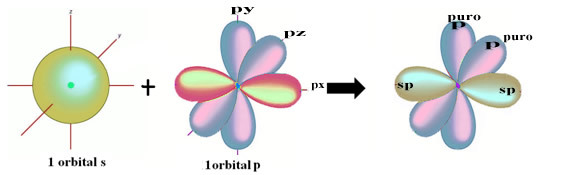
In der obigen Abbildung ist sehr deutlich, dass es zwei reine Orbitale gibt, die die Pi-Bindungen bilden.
Um zu verstehen, wie dies geschieht, nehmen wir als Beispiel ein Zyanidgasmolekül (HCN), das in den Vereinigten Staaten in Gaskammern für zum Tode verurteilte Gefangene verwendet wird. Seine Strukturformel ist gegeben durch:
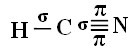
Was Kohlenstoff betrifft, so wurden seine Atomorbitale bereits gezeigt, schauen Sie sich nun die Wasserstoff- und Stickstofforbitale an:
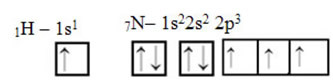
Beachten Sie, dass das ungepaarte Wasserstofforbital, das die Sigma-Bindung ausführt, das „s“ ist, das räumlich durch einen Kreis dargestellt wird; und Stickstofforbitale sind vom Typ „p“, dargestellt durch drei Doppelovoide (jeweils in einem räumlichen Feld: x, y, z). Somit wird die Struktur des HCN-Moleküls wie folgt dargestellt:
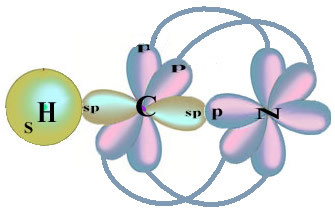
Was die Art der in dieser Formaldehydstruktur vorhandenen Bindungen betrifft, haben wir:
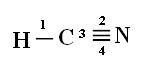
Anschlüsse: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm


