Diffusion und Erguss sind zwei Gesetze, die der schottische Chemiker Thomas Graham im 19. Gasgemische und das Verhalten von Gase wenn Sie durch die Wände eines Behälters gehen.
Unter den Beobachtungen von Thomas Graham zum Verhalten von Gasen in Bezug auf Diffusion und Effusion können wir Folgendes hervorheben:
Ein Gas hat immer die Tendenz, durch kleine Löcher in Festkörpern zu dringen;
Je größer die Molekülmasse Gas, desto schwieriger ist es, durch die Löcher der festen Materie zu gelangen;
Je geringer die Dichte des Gases ist, desto größer ist seine Bewegungsgeschwindigkeit;
Je höher die Temperatur, der ein Gas ausgesetzt ist, desto schneller breitet es sich in der Umgebung aus oder tritt durch eine Öffnung;
- Ein Gas bleibt niemals an einem bestimmten Ort statisch.
Diffusion
Diffusion Es ist ein physikalisches Phänomen, das in der Fähigkeit eines Gases besteht, sich im gesamten Raum eines Bereichs oder in einem Behälter zu diffundieren (d. h. auszubreiten). Aus diesem Grund können wir sagen, dass ein Gas in einem Raum niemals auf einen einzigen Ort beschränkt ist.

Darstellung des Auftretens einer Sendung
Außerdem können wir die Diffusion immer noch als die Kapazität, die ein Gas mit einem anderen zu vermischen hat, wenn es in denselben Behälter gegeben wird, um ein homogenes Gasgemisch zu bilden.
Ein Beispiel ist, wenn Gase aus Fahrzeugabgasen austreten. So giftig sie auch sind, sie verursachen beim Menschen keine kurzfristigen Schäden, da sie sich in der Luft verteilen und somit ihre Konzentration verringern.
Erguss
Erguss es ist ein physikalisches Phänomen, das darin besteht, dass ein Gas durch Löcher in den Wänden eines bestimmten Behälters geleitet wird, dh es besteht im Austritt eines Gases von einer Umgebung in eine andere.

Darstellung des Auftretens eines Ergusses
Ein Beispiel ist, wenn die Ballons für eine Party aufgeblasen werden und am nächsten Tag alle entleert werden, weil die Luft durch die Löcher in den Ballons entweicht.
Berechnungen zu Diffusion und Effusion
Wir können nach den von Graham vorgeschlagenen Gleichungen die Geschwindigkeit berechnen, mit der ein Gas arbeitet Diffusion oder Erguss. Nach Graham sind die Diffusions- und Effusionsraten zweier in einem Behälter gemischter Gase immer umgekehrt proportional zum Quadrat ihrer relativen Dichten oder ihrer Molmassen.
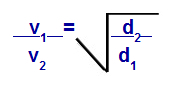
Grahams Gesetz in Bezug auf die Dichte Den
v1 = Geschwindigkeit (Effusion oder Diffusion) von Gas 1 in der Mischung;
v2 = Geschwindigkeit (Effusion oder Diffusion) des Gases 2 in der Mischung;
d1 = Dichte des Gases 1 der Mischung;
d2 = Dichte des Gases 2 der Mischung;
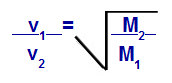
Grahamsches Gesetz über die Molmasse
v1 = Geschwindigkeit (Effusion oder Diffusion) von Gas 1 in der Mischung;
v2 = Geschwindigkeit (Effusion oder Diffusion) des Gases 2 in der Mischung;
M1 = Molmasse von Gas 1 der Mischung;
M2 = Molmasse von Gas 2 im Gemisch.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
