Base ist anorganische Substanz die nach Angaben des schwedischen Chemikers Svante Arrhenius, wenn es in Wasser gelegt wird, erleidet das Phänomen von ionische Dissoziation, in dem es die Veröffentlichung von Ionen: Kation (Y+) und Hydroxid-Anion (OH-).

Allgemeine Formel einer Arrhenius-Base
die Y-Gruppe von a Base es kann ein beliebiges Metall sein oder auch aus der Ammoniumgruppe (NH4+), die bei der Dissoziation als Kationen in Wasser freigesetzt werden, wie aus der Gleichung ersichtlich, die den Vorgang darstellt:
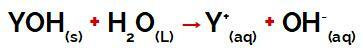
Gleichung, die die Dissoziation einer Base darstellt
Nachfolgend finden Sie einige sehr wichtige Informationen zur Klassifizierung und Nomenklatur von Basen.
1) Klassifizierung bezüglich der Löslichkeit von Basen(Fähigkeit zu lösen im Wasser)
Basen löslich: Alkalimetall oder Ammonium in der Zusammensetzung aufweisen;
Basen schwer löslich: haben Alkalisches Erdmetall in der Zusammensetzung. Beispiel: Magnesiumhydroxid, weit verbreitet als Antazida und Abführmittel;
Basen praktisch unlöslich
: ein beliebiges anderes Metall in der Zusammensetzung haben. Beispiel: Aluminiumhydroxid, weit verbreitet als Antazida.
2) Klassifizierung bezüglich der Basisstärke(Fähigkeit zu dissoziieren im Wasser)
Basen stark: Alkali- oder Erdalkalimetalle, mit Ausnahme von Magnesium, in der Zusammensetzung enthalten;
Basen schwach: ein beliebiges anderes Metall in der Zusammensetzung haben.
3) Basisnomenklatur
Um eine Basis zu benennen, befolgen Sie einfach die folgende Benennungsregel:
Hydroxid + de + Name von Metall oder Ammonium
Beispiel: Ca(OH)2 → Calciumhydroxid
Wenn die Base ein chemisches Element enthält, das nicht zu den Familien IA, IIA oder IIIA gehört (und das ist nicht das Silber oder Zink), müssen wir vor dem Namen des Elements in römischen Ziffern die Anzahl der Hydroxyle:
Beispiel: Ti (OH)4 → Titanhydroxid IV
Von mir. Diogo Lopes
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm