Einige Verbindungen benötigen keine acht Elektronen in der Valenzschale, um Stabilität zu erreichen, daher gelten sie als Ausnahmen von der Oktettregel. Erfahren Sie jetzt, warum einige Elemente der Verpflichtung entgehen, ein Elektronenoktett in der letzten Schale zu haben.
Beryllium (Sein)
Es ist eine Ausnahme von der Oktettregel, weil es Verbindungen mit zwei Einfachbindungen bilden kann, also mit nur vier Elektronen in der Valenzschale stabilisiert. 
Da Wasserstoff (H) zwei Elektronen abgeben muss, um die Bindung (H - Nun - H), teilt das Beryllium (Be)-Atom seine Elektronen und erreicht Stabilität.
Aluminium (Al)
Es ist eine Ausnahme von der Oktettregel, weil es Stabilität mit sechs Elektronen in der Valenzschale erreicht. Das Aluminiumatom neigt dazu, seine Elektronen abzugeben und kann so drei Einfachbindungen mit anderen Atomen eingehen: 
In diesem Fall bildete Aluminium (Al) drei Bindungen mit drei Fluor (F)-Atomen.
Bor (B)
Es bildet molekulare Substanzen mit drei Einfachbindungen.
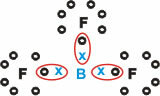
Beachten Sie, dass Bor (B) dazu neigt, seine Elektronen an Fluoratome (F) abzugeben, was der Oktettregel gehorcht und acht Elektronen in der Valenzschale benötigt. Da Bor seine Elektronen abgibt, stabilisiert sich Fluor mit dem gebildeten Oktett.
Von Líria Alves
Abschluss in Chemie
Brasilianisches Schulteam
Mehr sehen!
Oktetttheorie
Allgemeine Chemie - Chemie - Brasilien Schule
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

