DAS Löslichkeit oder Löslichkeitskoeffizient, es ist eine physikalische Eigenschaft der Materie, die praktisch immer im Labor bestimmt wird. Es hängt mit der Kapazität zusammen, die ein Material, genannt gelöst, Geschenke zur Auflösung durch einen anderen, die Lösungsmittel.
Was die Löslichkeit betrifft, können gelöste Stoffe wie folgt klassifiziert werden:
Löslichkeiten: solche, die sich im Lösungsmittel lösen. Natriumchlorid (gelöster Stoff) ist beispielsweise in Wasser (Lösungsmittel) löslich;
Schwach löslich: solche, die Schwierigkeiten haben, sich im Lösungsmittel aufzulösen. Dies ist der Fall von Calciumhydroxid [Ca(OH)2] (gelöst) in Wasser;
Unlösliche Stoffe: diese lösen sich nicht im Lösungsmittel auf. Sand (gelöster Stoff) zum Beispiel ist in Wasser unlöslich.
DAS Löslichkeit ist sehr mit der Vorbereitung von verbunden Lösungen (homogene Mischungen), da es zum Erhalt einer Lösung wesentlich ist, dass der verwendete gelöste Stoff im Lösungsmittel löslich ist.
Einflussfaktoren auf die Löslichkeit
Auch wenn der gelöste Stoff im Lösungsmittel löslich ist, gibt es einige Faktoren, die die Auflösungsfähigkeit des gelösten Stoffes beeinflussen können. Sind sie:
a) Beziehung zwischen der Menge an gelöstem Stoff und Lösungsmittel
Das Lösungsmittel hat immer eine Grenze der gelösten Stoffe, die es lösen kann. Wenn wir die Lösungsmittelmenge erhöhen, während die Menge an gelöstem Stoff beibehalten wird, neigt das Lösungsmittel dazu, den gesamten verwendeten gelösten Stoff aufzulösen.
B) Temperatur
Die Temperatur ist der einzige physikalische Faktor, der die Löslichkeit eines Lösungsmittels in Bezug auf einen bestimmten gelösten Stoff modifizieren kann. Diese Modifikation hängt von der Art des gelösten Stoffes ab, wie wir unten sehen werden:
endothermer gelöster Stoff: ist diejenige, bei der wir eine größere Masse lösen können, solange das Lösungsmittel eine Temperatur höher als Raumtemperatur hat. Je heißer das Lösungsmittel, desto mehr gelöste Stoffe lösen sich auf.
Beispiel: Es ist möglich, eine größere Menge gemahlenen Kaffees aufzulösen, wenn das Wasser heiß ist.
Exothermer gelöster Stoff: ist diejenige, bei der wir eine größere Masse lösen können, solange das Lösungsmittel eine Temperatur unter Raumtemperatur hat. Je kälter das Lösungsmittel, desto mehr gelöste Stoffe lösen sich auf.
Beispiel: Es ist möglich, eine größere Menge Kohlendioxid aufzulösen, wenn das Soda kalt ist.
Möglichkeiten zur Bestimmung der Löslichkeit
Da es sich bei der Löslichkeit um eine experimentell ermittelte Eigenschaft handelt, wurden die Materialien im Allgemeinen bereits in den unterschiedlichsten Lösungsmitteln auf ihre Löslichkeit untersucht. Somit können wir die Löslichkeit eines gelösten Stoffes in einem bestimmten Lösungsmittel wie folgt ermitteln:
a) Analyse einer Tabelle
Oft kann der Schüler bei der Interpretation einer Tabelle auf Löslichkeit stoßen. Siehe folgendes Beispiel:
Beispiel: (UEPG - angepasst) Die folgende Tabelle zeigt die Löslichkeit von Li-Salz2CO3 in 100 Gramm Wasser.

Die Tabelle zeigt die Massewerte in Gramm Li2CO3 die in 100 Gramm Wasser aufgelöst werden kann, von 0 ÖC bis 50 Ö. Wir sehen, je heißer das Wasser, desto weniger Li2CO3 löst sich. Deshalb, Li2CO3 es ist ein exothermer gelöster Stoff (er löst sich stärker auf, wenn das Wasser kalt ist).
b) Analyse eines Graphen
Die Löslichkeit kann durch die Interpretation eines Diagramms bewertet werden. Bestimmen Sie dazu einfach die Temperatur, drehen Sie sie auf die Kurve und dann die Kurve auf die y-Achse, die die Masse in Gramm des gelösten Stoffes ist.
Beispiel: (UFTM - adaptiert) Die Grafik zeigt die Löslichkeitskurve eines AX-Salzes2.
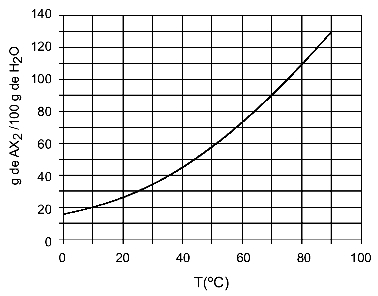
Die Grafik zeigt, dass auf der y-Achse die Wassermenge (Lösungsmittel) 100 Gramm beträgt. Für gelöste AX2, bestimmen wir die Wassermenge bei folgenden Temperaturen:
30Ö: Wenn wir die Temperatur 30. einschaltenÖC zur Kurve und dann die Kurve zur y-Achse haben wir, dass bei dieser Temperatur die 100 Gramm Wasser ungefähr 35 Gramm des gelösten AX. lösen können2.
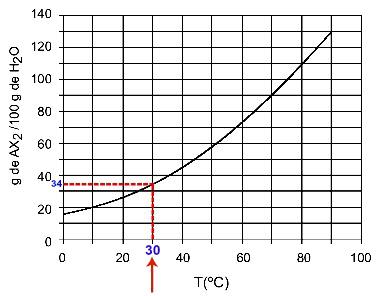
Bestimmung der AX-Löslichkeit2 bei 30ÖÇ
40Ö: Wenn wir die Temperatur 40. einschaltenÖC zur Kurve und dann die Kurve zur y-Achse haben wir, dass bei dieser Temperatur die 100 Gramm Wasser ungefähr 45 Gramm des gelösten AX. lösen können2.
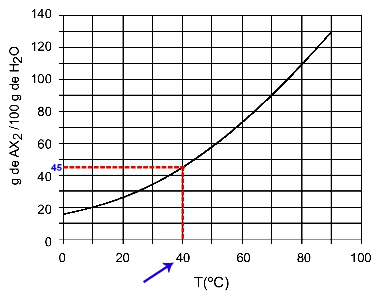
Bestimmung der AX-Löslichkeit2 bei 40ÖÇ
Da die gelöste Menge an gelöstem Stoff mit jeder Temperaturerhöhung größer wird, ergibt sich AX2 es ist ein endothermer gelöster Stoff.
c) Textinterpretation
Siehe folgendes Beispiel:
Beispiel: (PUC-MG) Bestimmte Stoffe können mit anderen Stoffen homogene Mischungen bilden. Die Substanz mit der größten Menge wird als Lösungsmittel und die Substanz mit der geringsten Menge als gelöster Stoff bezeichnet. Natriumchlorid (NaCl) bildet mit Wasser eine homogene Lösung, in der bei 20 °C 36 g NaCl in 100 g Wasser gelöst werden können.
Der Text besagt, dass, wenn wir 100 Gramm Wasser (Lösungsmittel) haben, bei einer Temperatur von 20 ÖC ist es möglich, bis zu 36 Gramm NaCl aufzulösen.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm

