Doppelsalz ist der Name einer der Klassifikationen, die anorganische Salze kann empfangen. Die anderen Klassifizierungen sind: einfach, Alaun, hydroxyliert, hydriert und hydratisiert. Um als Doppelsalz charakterisiert zu werden, muss ein anorganisches Salz eine der nachfolgend beschriebenen Kombinationen aufweisen:
Ein Kation (Y) und zwei beliebige Anionen (X und W) und wird durch die folgende Formel dargestellt:
YXW
Ein Anion (X) und zwei beliebige Kationen (Y und Z) und wird durch die folgende Formel dargestellt:
YZX
Hinweis: Diese Salze werden gebildet, wenn a Neutralisierungsreaktion wird zwischen zwei durchgeführt Basen anders und eins Acid, oder zwischen zwei verschiedenen Säuren und einer Base.
Namensregel für ein Doppelsalz
Um zu benennen Doppelsalz, ist es zunächst notwendig, seine Zusammensetzung zu kennen, denn für jede Art von Doppelsalz gibt es eine spezifische Namensregel, wie unten zu sehen ist:
a) Nomenklaturregel für Doppelsalz mit zwei Kationen
Wenn einer Doppelsalz zwei Kationen hat, müssen wir die folgende Regel anwenden:

Nomenklaturregel für Doppelsalze mit zwei Kationen
Im Folgenden sind zwei Anwendungsbeispiele für diese Namensregel aufgeführt:
1. Beispiel: Linie4so
Dieses Salz besteht aus:
Anion: Sulfid (S-2);
Elektropositiveres Kation: Lithium (Li+1);
Weniger elektropositives Kation: Ammonium (NH4+1).
Daher ist sein Name Lithium-(Doppel-)Ammoniumsulfid.
2. Beispiel: RbCaBO3
Dieses Salz besteht aus:
Anion: Borat (BO3-3);
Mehr elektropositives Kation: Rubidium (Rb+1);
Weniger elektropositives Kation: Calcium (Ca+2).
Daher ist sein Name Borat (Doppel) von Rubidium und Kalzium.
b) Nomenklaturregel für Doppelsalz mit zwei Anionen
Wenn einer Doppelsalz zwei Anionen hat, müssen wir die folgende Regel anwenden:
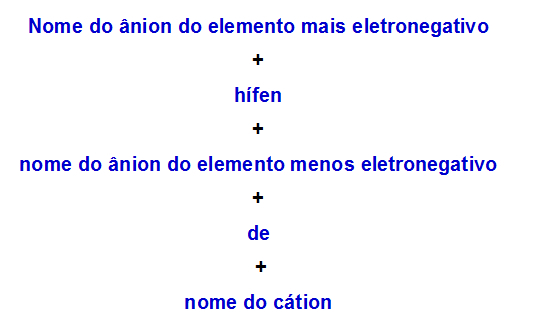
Nomenklaturregel für Doppelsalze mit zwei Anionen
Hier sind zwei Beispiele für die Anwendung dieser Regel:
1. Beispiel: MgFI
Dieses Salz besteht aus:
Kation: Magnesium (Mg+2);
Elektronegativstes Anion: Fluorid (F-1);
Weniger elektronegatives Anion: Jodid (I-1).
Daher ist sein Name Magnesiumfluorid-Iodid.
2. Beispiel: ZnNO2br
Dieses Salz besteht aus:
Kation: Zink (Zn+2);
Mehr elektronegatives Anion: Nitrit (NO2-1);
Weniger elektronegatives Anion: Bromid (Br-1).
Daher ist sein Name Zinknitrit-Bromid.
Zusammensetzen der Formel eines Doppelsalzes aus seiner Nomenklatur
a) Für Doppelsalz mit zwei Kationen
Die Konstruktion der Formel von a Doppelsalz es kommt darauf an, seinen Namen zu kennen, der wie bei allen Salzen standardisiert ist, also zuerst das Kation und dann das Anion. Da das Doppelsalz zwei Kationen haben kann, folgen ihre Reihenfolge und Platzierung in der Formel dem Vornamen.
1. Beispiel: Barium-Nickel-Pyrophosphat II
Dieses Salz enthält Phosphat (P2Ö7), Barium (Ba+2) und Nickel II (Ni+2), Kationen in dieser Reihenfolge geschrieben. Seine Formel lautet also BaNiP2Ö7.
2. Beispiel: Kupfer II Phosphat und Gold I
Dieses Salz enthält Phosphat (PO4-3), Kupfer II (Cu+2) und Gold I (Au+1), Kationen in dieser Reihenfolge geschrieben. Daher lautet seine Formel CuAuPO4.
b) Für Doppelsalz mit zwei Anionen
Im Falle von Doppelsalz bei zwei Anionen folgen wir beim Einsetzen der Anionen in die Formel auch der Reihenfolge, wie sie im Vornamen erscheinen.
1. Beispiel: Nickelsulfat-Iodid III
Dieses Salz hat Sulfatanionen (SO4-2) und Jodid (I-1), geschrieben in dieser Reihenfolge, und das Nickel-III-Kation (Ni+3). Seine Formel lautet also NiSO4ICH.
2. Beispiel: Bleicyanidphosphat IV
Dieses Salz hat Phosphatanionen (PO4-3) und Cyanid (CN-1), in dieser Reihenfolge geschrieben, und das Bleikation IV (Pb+4). Seine Formel lautet also PbPO4KN.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm

