Sie Gase Sie sind Flüssigkeiten die im Gegensatz zu Flüssigkeiten den gesamten verfügbaren Raum des Behälters einnehmen, in dem sie eingeschlossen sind. Die Moleküle, aus denen die Gase bestehen, können sich frei bewegen und miteinander und mit den Wänden des Behälters interagieren.
Ö perfektes oder ideales Gas es ist ein idealisiertes Gas, hat besondere Eigenschaften und erfüllt die Allgemeines Gasrecht und der Clapeyrons Gleichung.
Eigenschaften perfekter Gase
Da ist nicht Gravitationswechselwirkung zwischen Molekülen;
Beim Kollisionen unter den Molekülen sind perfekt elastisch, d. h. die kinetische Energie wird vollständig erhalten;
Moleküle zeigen eine ungeordnete Bewegung und Drehzahlen, die direkt vom Gastemperaturwert abhängen;
Das richtige Volumen jedes Moleküls ist im Vergleich zum Gesamtvolumen des Gases völlig unbedeutend.
Zustandsvariablen
Druck, Temperatur und Volumen sind die skalare physikalische Größen die ein Gas charakterisieren. Diese Größen werden Zustandsvariablen genannt und halten Beziehungen von Verhältnismäßigkeit.
DAS Boyles Gesetzbestimmt, dass die Beziehung zwischen Druck und Volumen eines Gases umgekehrt proportional ist. Je größer der Druck auf die Moleküle ist, desto weniger Platz nehmen sie ein.
DAS Gay-Lussac-Gesetzbestimmt, dass die Beziehung zwischen Volumen und Temperatur eines Gases direkt proportional ist. Je höher die Temperatur eines Gases ist, desto größer ist die Bewegung der Moleküle, die dazu neigen, sich auseinander zu bewegen, wodurch der von ihnen eingenommene Raum vergrößert wird.
Charles' Gesetz bestimmt, dass die Beziehung zwischen Druck und Temperatur eines Gases direkt proportional ist. Je höher die Temperatur eines Gases ist, desto stärker ist die molekulare Bewegung. Somit nimmt die Häufigkeit von Kollisionen zwischen den Molekülen und den Wänden des Behälters zu, wodurch der Druck des Gases größer wird.
DAS Clapeyron-Gleichung es synthetisiert die drei oben vorgestellten Gesetze und bestimmt eine einzelne Beziehung zwischen den Zustandsvariablen.
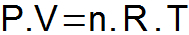
P = Gasdruck (atm oder N/m2);
V = Gasvolumen (L oder m3);
n = Anzahl der Maulwürfe;
R = universelle Gaskonstante (0,082 atm.l/mol. K oder 8,31 J/mol. K);
T = Gastemperatur (K).
Ideales Gas in der Natur
Die Natur produziert keine Gase, die die Eigenschaften eines perfekten Gases haben. Das ideale Gas ist ein theoretisches und nützliches Modell zum Verständnis des Verhaltens von Gasen angesichts von Veränderungen ihrer Eigenschaften.
Von Joab Silas
Abschluss in Physik
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm


