Halogenierungsreaktionen sind eine Art organischer Substitutionsreaktionen, d. h. solche, bei denen a Atom oder Atomgruppen werden durch Atome oder Atomgruppen eines anderen Moleküls ersetzt organisch.
Im Allgemeinen findet diese Art der Reaktion mit Alkanen und aromatischen Kohlenwasserstoffen (Benzol und seine Derivate) statt.
Halogenierung wird so genannt, weil sie mit den einfachen Substanzen der Halogene auftritt: F2, Cl2, Bruder2 Hallo2. Am häufigsten sind jedoch Chlorierungen (Cl2) und Bromierung (Br2), da Fluor sehr reaktiv ist und seine Reaktionen explosiv und schwer zu kontrollieren sind und sogar organisches Material zerstören:
CH4(g) + 2 F2(g) → C(s) + 4HF(G)
Reaktionen mit Jod sind extrem langsam.
Im Folgenden sind die wichtigsten Arten der Halogenierung und einige Beispiele aufgeführt:
1. Halogenierung mit Alkanen: Da Alkane wenig reaktiv sind, laufen ihre Halogenierungsreaktionen nur in Gegenwart von Sonnenlicht (λ), ultraviolettem Licht oder starker Erwärmung ab. Diese Art von Reaktion wird durchgeführt, um ein Alkylhalogenid zu erhalten.
Beispiel: Methanmonochlorierung:
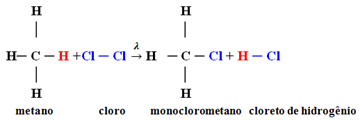
In diesem Fall geschah es aus einem Wasserstoffatom von Methan (CH4) durch ein Chloratom ersetzt werden, wodurch Monochlormethan entsteht. Wenn zu viel Chlor vorhanden war, konnte diese Reaktion weiterlaufen und alle Wasserstoffe im Methan ersetzen.
1.1. Halogenierung in Alkanen mit mehr als 3 Kohlenstoffatomen: Wenn das umzusetzende Alkan mindestens 3 Kohlenstoffatome hat, erhalten wir eine Mischung unterschiedlicher substituierter Verbindungen. Siehe das folgende Beispiel einer Methylbutan-Monochlorierung:
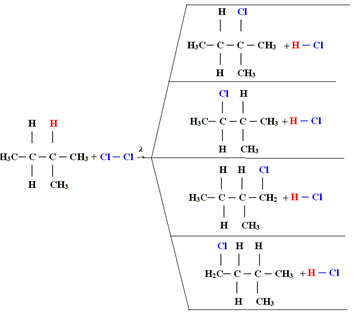
Die Menge jeder Verbindung ist proportional zu der folgenden Leichtigkeit, mit der Wasserstoff in das Molekül freigesetzt wird:

Somit ist im obigen Fall die größte Menge 2-Methyl-2-chlorbutan und die kleinste Menge 2-Methyl-1-chlorbutan.
2. Benzolhalogenierung: Benzol reagiert normalerweise nicht mit Chlor oder Brom. Wenn jedoch eine Lewis-Säure als Katalysator verwendet wird (normalerweise wird FeCl verwendet3, FeBr3 oder AlCl3, alle in wasserfreier Form), reagiert Benzol leicht in einer Halogenierungsreaktion.
Das Chlorid und Eisen(III)-bromid können durch einfache Zugabe von Eisen zur Mischung erhalten werden und auf diese Weise reagiert es mit dem Halogen und erzeugt die Lewis-Säure:
2 Fe + 3 Br2 → 2 FeBr3
Siehe ein Beispiel für Benzolhalogenierung und ihren Mechanismus:
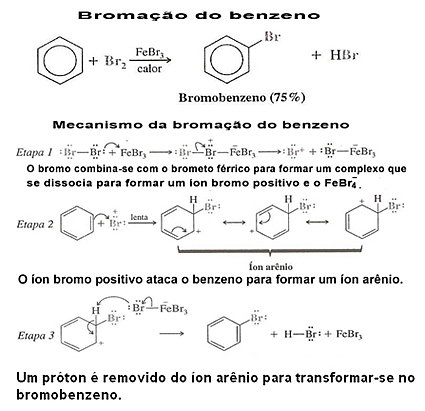
3. Halogenierung von Benzolderivaten:In solchen Fällen richtet sich die Substitution nach dem Substituenten oder der funktionellen Gruppe, die an den aromatischen Kern gebunden ist. Um zu sehen, wie dies geschieht, lesen Sie die Texte "Lenkungsradikale im Benzolring" und "Elektronische Effekte von meta- und ortho-to-directors-Radikalen”.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/reacoes-organicas-halogenacao.htm

