Oxidations-Reduktions-Reaktionen, die in Gegenwart von Wasserstoffperoxid (wässrige Lösung von Wasserstoffperoxid - H2Ö2 (wässrig)) stellen einen Sonderfall dar, der vor allem hinsichtlich seiner Ausgewogenheit gesondert analysiert werden muss. Dies liegt daran, dass die Sauerstoffe in Wasserstoffperoxid, bei denen Nox gleich -1 ist, entweder oxidieren oder reduzieren können.
Betrachten wir zum Beispiel zwei Fälle, in denen es sich zuerst als Oxidationsmittel (reduzierend) und dann als Reduktionsmittel (oxidierend) verhält:
- Oxidationsmittel: Wenn Wasserstoffperoxid als Oxidationsmittel reduziert wird, entsteht als Produkt Wasser.
Wenn wir einer Lösung mit Jodidionen (I-) in einem sauren Medium haben wir:
H2Ö2 (wässrig) + ich-(Hier) +H+(Hier) → H2Ö(1) + ich2(s)
Sehen Sie, dass Wasser und Jod gebildet werden. Um aber zu überprüfen, ob das Wasserstoffperoxid tatsächlich als Oxidationsmittel wirkt und reduziert, beobachten Sie die Bestimmung der Oxidationszahlen (NOx):*

Das Sauerstoff-Nox von Wasserstoffperoxid nahm von -1 auf -2 ab, vorausgesetzt, es erhielt 1 Elektron. Da wir jedoch in jedem Wasserstoffperoxidmolekül zwei Sauerstoffatome haben (H
2Ö2), wird die Nox-Variation gleich 2 sein.Also, wie im Text gezeigt „Redox-Balancing“ Ein notwendiger Schritt, um die Reaktionen durch die Oxidations-Reduktions-Methode auszugleichen, besteht darin, die Werte der Variationen des Nox durch die Koeffizienten zu invertieren, in diesem Fall wie folgt:
* H2Ö2 = 2 (∆Nox) = 2 → 2 ist der Koeffizient des I-;
* ICH-= ∆Nox = 1 → 1 ist der Koeffizient von H2Ö2.
Somit haben wir:
1 Stunde2Ö2 (wässrig) + 2 Ich-(Hier) + H+(Hier) → H2Ö(1) + ich2(s)
Treffen der anderen Koeffizienten durch Ausbalancieren durch Versuche:
- Da sich im 1. Glied zwei Sauerstoffatome befinden, muss der Wasserkoeffizient im 2. Glied gleich 2 sein. Und da auch im 1. Glied zwei Jodidionen vorhanden sind, beträgt der Jodkoeffizient im 2. Glied 1. Vergessen Sie nicht, dass wir den Index mit dem Koeffizienten multiplizieren müssen, um die richtige Menge an Atomen und Ionen in jedem Element zu finden:
1 Stunde2Ö2 (wässrig) + 2 Ich-(Hier) +H+(Hier) → 2 H2Ö(1) + 1 Ich2(s)
- Jetzt muss nur noch das Wasserstoffkation des 1. Mitglieds ausgeglichen werden, und sein Koeffizient muss gleich 2 sein, da es im 2. Mitglied 4 Wasserstoffe hat und im 1. Mitglied bereits zwei:
1 Stunde2Ö2 (wässrig) + 2 Ich-(Hier) +2 H+(Hier) → 2 H2Ö(1) + 1 Ich2(s)
- Reduktionsmittel: Wenn Wasserstoffperoxid als Reduktionsmittel oxidiert, erzeugt es Sauerstoff (O2) als Produkt.
Ein Beispiel für die Reduktion von Wasserstoffperoxid ist der Kontakt mit Kaliumpermanganat (KMnO4). Diese Substanz hat eine sehr charakteristische violette Farbe, aber wenn sie mit Wasserstoffperoxid in Kontakt kommt, wird sie farblos. Dies liegt daran, dass das gesamte im MnO-Ion vorhandene Mangan4- der Permanganatlösung reduziert, wodurch das Mn-Ion entsteht2+, Wie nachfolgend dargestellt:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2Ö2 + MnO4-+ H+ → Die2 + Mn2++ H2Ö
Wenn wir das NOx berechnen, sehen wir, dass der Sauerstoff in Wasserstoffperoxid tatsächlich oxidiert und die Reduktion von Mangan verursacht:
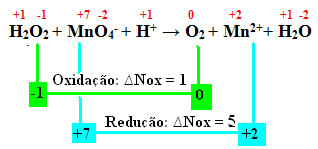
Wie im vorherigen Beispiel ist das ∆Nox von Wasserstoffperoxid gleich 2, da es zwei Sauerstoffatome gibt und jeder ein Elektron verliert. Daher haben wir:
* Ö2 = 2 (∆Nox) = 2 → 2 ist der Koeffizient von MnO4-;
*MnO4- = ∆Nox = 5 → 5 ist der Koeffizient des O2.
Und wie alle O2 kommt von Wasserstoffperoxid, die beiden Stoffe haben den gleichen Koeffizienten:
5 H2Ö2 + 2MnO4-+ H+ → 5 Ö2 + Mn2++ H2Ö
Auswuchten nach der Probemethode haben wir:
5 Stunden2Ö2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 Mio2++ 8 H2Ö
* Bei Fragen zur Berechnung der Oxidationszahl (Nox) von Atomen und Ionen in einer Reaktion lesen Sie den Text „Bestimmung der Oxidationszahl (Nox)“.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm