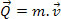Einer Pufferlösung Es ist eine Mischung, die verwendet wird, um zu verhindern, dass sich der pH- oder pOH-Wert des Mediums ändert, wenn starke Säuren oder starke Basen hinzugefügt werden.
Es gibt zwei Arten von Pufferlösungen:
1. Mischung aus schwacher Säure mit ihrer konjugierten Base;
2. Mischung einer schwachen Base mit ihrer konjugierten Säure.
Schauen wir uns Beispiele für jeden an und wie sie funktionieren, wenn dem Medium eine kleine Menge starker Säure oder Base zugesetzt wird:
1. Mischung aus schwacher Säure mit ihrer konjugierten Base:
Um eine solche Lösung zu bilden, wird die schwache Säure mit einem Salz des gleichen Anions wie die Säure gemischt.
Betrachten Sie beispielsweise eine Pufferlösung aus Essigsäure (H3CCOOH(Hier)) und Natriumacetat (H3CCOONa(s)). Sehen Sie, dass beide das Acetatanion haben: (H3CCOO-(Hier)). Die Konzentration dieser Ionen ist praktisch auf die Dissoziation des Salzes zurückzuführen, die groß ist. Die Säureionisation ist gering.

Beachten Sie nun, was bei den folgenden Additionsmöglichkeiten passiert:
- Zugabe einer kleinen Menge starker Säure:
Die Zugabe einer starken Säure erhöht die Konzentration des Hydroniumions H3Ö+1, und da Essigsäure eine schwache Säure ist, hat das Acetatanion eine hohe Affinität zum Proton (H+) Hydronium. Auf diese Weise reagieren sie und es wird mehr Essigsäure gebildet:

Dadurch ändert sich der pH-Wert des Mediums praktisch nicht. Wenn jedoch immer mehr starke Säure hinzugefügt wird, kommt der Zeitpunkt, an dem das gesamte Acetatanion verbraucht ist und die Pufferwirkung aufhört.
- Zugabe einer kleinen Menge starker Base:
Die Zugabe einer starken Base erhöht die Konzentration an OH-Ionen-. Aber diese Ionen werden durch die H-Ionen neutralisiert3Ö+1 bei der Ionisation von Essigsäure freigesetzt:

Bei dieser Reaktion ist die Konzentration der H-Ionen3Ö+1(Hier) sinkt und es kommt zu einer Verschiebung des Gleichgewichts in Richtung einer Erhöhung der Säureionisation und daher wird die pH-Änderung der Lösung sehr gering sein. Die Konzentration von H-Ionen3Ö+1(Hier) es wird praktisch konstant sein.
Auch in diesem Fall ist die Kapazität des Puffers begrenzt. Wenn wir daher immer mehr Basen hinzufügen, wird das Gleichgewicht der Säureionisierung immer mehr in Richtung ihrer Ionisierung verschoben, bis die gesamte Säure verbraucht ist.
2. Mischung einer schwachen Base mit ihrer konjugierten Säure:
Diese Art von Pufferlösung besteht aus einer schwachen Base und einer Salzlösung, die das gleiche Kation wie die Base enthalten.
Betrachten Sie beispielsweise eine Pufferlösung aus Magnesiumhydroxid, MgOH .2 (wässrig) (schwache Base) und Magnesiumchlorid, MgCl2(s) (Salz). Beide enthalten das Kation Magnesium (Mg2+(Hier)). Die im Medium vorhandenen Magnesiumionen stammen praktisch alle aus der Dissoziation des Salzes, da die Dissoziation der Base schwach ist:
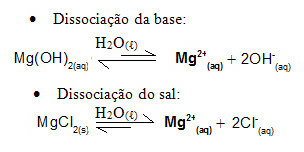
- Zugabe einer kleinen Menge starker Säure:
In diesem Fall sind die H-Ionen3Ö+1 durch Zugabe von starker Säure wird durch OH-Ionen neutralisiert-, aus schwacher Basendissoziation. Dadurch verschiebt sich das Basisdissoziationsgleichgewicht nach rechts.
Daher ist die pH-Variation (falls vorhanden) sehr gering, da die Konzentration der OH-Ionen- bleibt konstant. Der Puffereffekt wird aufhören, wenn die gesamte Base dissoziiert ist.
- Zugabe einer kleinen Menge starker Base:
Die zugegebene starke Base dissoziiert unter Freisetzung von OH-Ionen-. Da Magnesiumhydroxid eine schwache Base ist, reagiert das bei der Dissoziation aus dem Salz freigesetzte Magnesium stärker mit dem OH-:

Daher ist die Zunahme der OH-Ionen- wird durch den proportionalen Anstieg von Mg(OH) ausgeglichen2 (wässrig). Somit unterliegt der pH-Wert keinen größeren Änderungen.
Dieser Effekt endet, wenn das gesamte Magnesiumkation verbraucht ist.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm