DAS Stereoisomerie, auch bekannt als Weltraumisomerie, ist eine Art von Isomerie, bei der sich ihre Isomere dadurch unterscheiden, dass die Bindungen zwischen ihren Atomen im Raum unterschiedlich angeordnet sind.
Es gibt zwei Arten von Stereoisomeren, die Diastereoisomere und der Enantiomere. Diastereoisomere sind geometrische Isomere vom cis-trans-Typ, die keine Spiegelbilder voneinander sind, während Enantiomere optische Isomere sind, die Spiegelbilder voneinander sind.
Ein bisschen reden über die cis-trans-Diastereoisomer, es kommt nur in Verbindungen vor, die ungesättigt oder zyklisch sind. Warum kommt es nicht in gesättigten Kettenverbindungen vor, das heißt, die nur Einfachbindungen zwischen Kohlenstoffen haben?
Es kann vorkommen, dass wir verwirrt werden, wenn wir denken, dass bestimmte gesättigte Verbindungen Diastereoisomere sind, obwohl sie tatsächlich dieselbe Verbindung darstellen. Im Folgenden haben wir beispielsweise drei räumliche Konformationen der Atome von 1,2-Dichlorethan:
H H H H H Cl
│ │ │ │ │ │
H — Ç — Ç — H H — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
Cl ClCl H Cl H
Sind das drei Diastereoisomere? Unterlassen Sie. Tatsächlich, die drei Moleküle sind von derselben Verbindung. Was passiert, ist, dass die Einfachbindungen oder Sigma (σ) zwischen Kohlenstoffen Rotationen erfahren können, was zu unterschiedlichen Atomanordnungen führt.
Sehen Sie, wie dies im folgenden Schema mit Ethan geschieht:

Diese Verbindungen, die eigentlich dieselbe Verbindung sind, führen keine geometrische cis-trans-Isomerie durch, sondern heißen Konformationsisomere, da sie sich nur in der Konformation ihrer Atome aufgrund der Rotation um die Einfachbindung unterscheiden.
Eine der Möglichkeiten, diese Moleküle darzustellen, um die Drehung der Verbindungsachse leicht zu visualisieren, ist durch die Newmans Projektion, bei der angenommen wird, dass die Sehebene genau auf der Achse der Bindung zwischen den Kohlenstoffen liegt und sie durch einen zentralen Kreis dargestellt werden. Siehe Newmans Projektion für Ethan:

Wir können diese verschiedenen Konformationen auch durch die Formel auf Staffeleien:
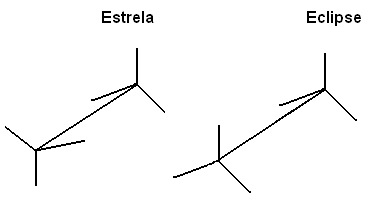
Diese freie Drehung der Verknüpfungsachse tritt bei ungesättigten Verbindungen oder bei zyklischen Verbindungen nicht mehr auf. Stellen Sie sich zum Beispiel vor, wir bauen ein einfaches Modell, das zwei Kohlen durch zwei Styroporkugeln darstellt, die durch einen darin steckenden Zahnstocher verbunden sind.
Wenn wir einen einzelnen Zahnstocher haben und eine der Kugeln halten, kann sich die andere leicht um die eigene Achse drehen, genau wie beim einfachen Binden.

Wenn wir jedoch einen weiteren Zahnstocher einsetzen, der die beiden Kugeln verbindet, können wir eine Kugel nicht halten und die andere nicht drehen. Wenn wir dies tun, brechen die Zahnstocher. Ebenso besteht bei einer Pi-Bindung und einer Sigma (Doppelbindung) ein Hindernis für die Rotation der Kohlenstoffe.
Im folgenden Fall, in dem wir eine Doppelbindung zwischen den Kohlenstoffen haben, handelt es sich also nicht um zwei Konformationsisomere, also um zwei Konformationen für dasselbe Molekül; wir haben eigentlich zwei cis-trans-Diastereoisomere:
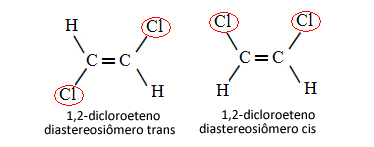
Weitere Informationen zu dieser Art von Isomerie finden Sie im Text Geometrische oder cis-trans-Isomere.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm

