DAS milde Oxidation in Alkenen ist eine organische Reaktion, die durchgeführt wird, wenn ein gegebenes Alken wird in ein Medium aus einer Base mit Wasser und Kaliumpermanganatsalz (KMnO4), Salz, das allgemein als bezeichnet wird Bayer-Reagenz.
Das gebildete Produkt heißt Alkohol vicinale, d. h. Alkohole mit zwei Hydroxylgruppen (OH-) auf benachbarten Kohlenstoffen positioniert, wie in der folgenden allgemeinen Formel:
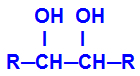
HINWEIS: R kann ein Rest oder Wasserstoffatome sein.
Bayer-Reagenz
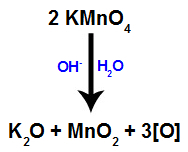
Wenn der Bayers Reagenz (KMnO4) wird mit Wasser in Gegenwart einer anorganischen Base (OH-), reagiert es und bildet Kaliumoxid (K2O), Mangandioxid (MnO2) und entstehende Sauerstoffe (freier Sauerstoff, dargestellt durch [O]). Siehe die ausgewogene Gleichung des Prozesses.

Diese aus dem Bayer-Reagens gebildeten entstehenden Sauerstoffe sind für die milde Oxidationsreaktion in Alkenen verantwortlich (wie wir in den folgenden Punkten sehen werden).
Mechanismen einer milden Oxidationsreaktion in Alkenen
1. Mechanismus: Bildung von naszierendem Sauerstoff aus Bayers Reagenz;
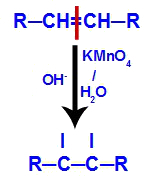
2. Mechanismus: Angriff naszierenden Sauerstoffs auf die im Alken vorhandene Doppelbindung, wodurch die pi-Bindung und daraus folgende Bildung einer freien Valenz in jedem der am. beteiligten Kohlenstoffe pi-Link.
3. Mechanismus: Entstehende Sauerstoffe vereinen sich mit Hydronium (H+) entsteht durch die Selbstionisation von Wasser, wodurch Hydroxylgruppen (OH-).
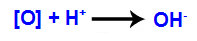
4. Mechanismus: Verbindung der in jeder der freien Valenzen gebildeten Hydroxyle an den Kohlenstoffatomen, wo die pi-Bindung war, wodurch ein vicinaler Dialkohol entsteht.

Beispiele für milde Oxidationsreaktionen in Alkenen
→ Milde Oxidationsreaktion an But-2-en
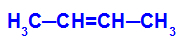
Strukturformel von But-2-en
Anfänglich wird die Doppelbindung zwischen den Kohlenstoffatomen 2 und 3 des Alkens durch den Angriff naszierender Sauerstoffe aufgebrochen, wodurch eine freie Valenz (vertikale Spur) an den Kohlenstoffatomen 2 und 3 entsteht.

Aufbrechen der pi-Bindung zwischen den Kohlenstoffen 2 und 3 in But-2-en
Dann vereint sich der entstehende Sauerstoff mit einem Hydronium (H+) aus der Ionisierung von Wasser unter Bildung von Hydroxylgruppen (OH-), die an die freien Valenzen der Kohlenstoffatome 2 und 3 binden, was zu einem vicinalen Dialkohol führt.
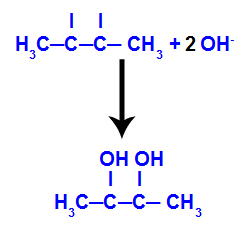
Vicinaler Alkohol aus But-2-en
→ Milde Oxidationsreaktion an 2-Methylpropen
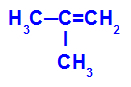
Strukturformel von 2-Methyl-propen
Anfänglich wird die Doppelbindung zwischen den Kohlenstoffen 1 und 2 des Alkens durch den Angriff naszierender Sauerstoffe aufgebrochen, wodurch eine freie Valenz (vertikale Spur) an den Kohlenstoffen 1 und 2 entsteht.
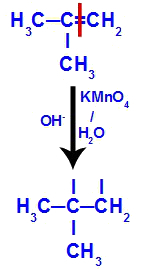
Aufbrechen der pi-Bindung zwischen den Kohlenstoffatomen 1 und 2 in 2-Methylpropen
Dann vereint sich der entstehende Sauerstoff mit einem Hydronium (H+) aus der Ionisierung von Wasser unter Bildung von Hydroxylgruppen (OH-), die an die freien Valenzen der Kohlenstoffatome 1 und 2 binden, was zu einem vicinalen Dialkohol führt.
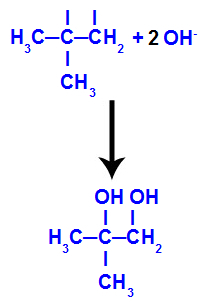
Vicinaler Alkohol aus 2-Methylpropen
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/oxidacao-branda-alcenos.htm
