Wenn wir zu Hause Essen kochen, verwenden wir Kochgasverbrennung. Eines der Dinge, die wir in der Flamme sehen können, die aus der Verbrennung dieses Gases entsteht, ist, dass seine Farbe normalerweise sehr hellblau ist. Bei den meisten Verbrennungsreaktionen, wie dem Verbrennen einer Kerze, ist die Flamme jedoch gelb.

Dann stellt sich die Frage:
"Wenn jedes Feuer das Ergebnis einer Verbrennungsreaktion ist, warum haben dann manche Flammen unterschiedliche Farben?"
Um zu verstehen, wie dies geschieht, müssen wir verstehen, was eine Verbrennungsreaktion ist und welche Substanzen in jeder der genannten Reaktionen vorhanden sind.
Eine Verbrennungsreaktion tritt auf, wenn ein Brennstoff (oxidierbares Material) von einem Oxidationsmittel (ein gasförmiges Material, das Sauerstoff enthält) verbraucht wird, um thermische Energie (Wärme) zu erzeugen.
Ein weiterer wichtiger Punkt, den wir über Verbrennungsreaktionen wissen müssen, ist, dass sie in einem vollständig oder unvollständig. Wenn genügend Sauerstoff vorhanden ist, um den Kraftstoff zu verbrauchen, ist die Reaktion abgeschlossen und es entsteht Kohlendioxid (CO
2) und Wasser (H2Ö). Andernfalls ist die Verbrennung teilweise, unvollständig und erzeugt Kohlenmonoxid (CO) und Wasser; oder Kohlenstoff (C) und Wasser.In beiden Fällen analysieren wir, das Oxidationsmittel ist der in der Luft vorhandene Sauerstoff. Kraftstoffe sind jedoch unterschiedlich. Kochgas ist eigentlich Flüssiggas (LPG), ein Gemisch aus Kohlenwasserstoffen (Alkanen), wobei der Hauptbrennstoff Butan (C4H10). Kochgas besteht also aus Alkanmolekülen, die nur drei oder vier Kohlenstoffatome, deshalb wird wenig Sauerstoff benötigt, damit seine Verbrennung vollständig abläuft. Diese Reaktion kann wie folgt ausgedrückt werden:
1C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 Stunden2Ö(G), H < 0
Bei Kerzen ist das Paraffin der Treibstoff für die Reaktion, und es besteht aus einer Mischung von Alkanen mit Kohlenstoffatomen, die Bereich von 20 bis 36. Damit, es braucht viel mehr Sauerstoff, damit diese Reaktion vollständig abläuft. Siehe ein Beispiel:
1C24H50(s) + 70/2 O2(g) → 25 CO2(g) + 25 H2Ö(G), H < 0
In der Luft ist nicht genug Sauerstoff vorhanden, um diese vollständige Verbrennung durchzuführen, daher findet sie unvollständig statt, wie unten gezeigt:
1C24H50(s) +49/2 O2(g) → 24 CO(G) + 25 H2Ö(G), H < 0
1C24H50(s) +25/2 O2(g) → 24C(s) + 25 H2Ö(G), H < 0
Unvollständige Reaktionen erzeugen weniger Energie als eine vollständige Verbrennung. Dies erklärt den Unterschied zwischen den Farben der Flammen, da die gelbe Flamme, die für eine unvollständige Verbrennung charakteristisch ist, eine geringere Energie hat. Die blaue Flamme ist charakteristisch für eine vollständige Verbrennung mit größerer Energie.
Dies erklärt auch die Rußbildung durch die Kerzenflamme (siehe Abbildung unten), bei der es sich um Kohlenstoff handelt, der als Produkt einer unvollständigen Verbrennung angesehen wird.
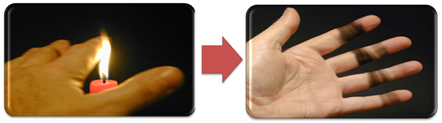
Aber warum kann es beim Bunsenbrenner zu gelben und blauen Flammen kommen, wenn sich der Brennstoff nicht ändert?
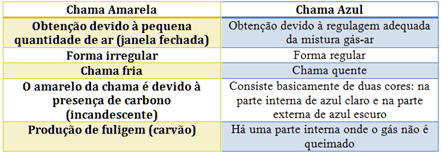
Beim Bunsenbrenner wird dies durch die Regulierung der Gas- und Luftzufuhr erreicht. Wenn das Fenster geschlossen ist und eine geringe Luftmenge eindringt, wird die erhaltene Flamme gelb, da sie wenig Sauerstoff enthält, um eine vollständige Verbrennung durchzuführen. Bei ausreichender Regulierung des Gas-Luft-Gemisches erhalten wir eine blaue Flamme.
Sehen Sie sich die jeweiligen Eigenschaften in der folgenden Tabelle an:
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
