| DAS Diffusion eines Gases ist eine spontane Bewegung eines Gases durch ein anderes, dh seine Ausbreitung in einem anderen gasförmigen Medium. |
Aus diesem Gasgemisch entstehen homogene Gemische oder gasförmige Lösungen. Zum Beispiel verteilen sich die Gase, die aus Fabrikschornsteinen oder Autoabgasen kommen, durch die Luft atmosphärisch und im Laufe der Zeit konnten wir sie nicht mehr unterscheiden, da diese Gase durch die Luft.

Die von den Schornsteinen ausgestoßenen Gase werden diffundiert und „verlieren“ sich in der atmosphärischen Luft, da das Luftvolumen viel größer ist als das des Rauchs.
| DAS Erguss von Gasen ist eine besondere Art der Diffusion, bei der Gase durch kleine Löcher (oder poröse Wände, die eine Reihe kleiner Löcher sind) austreten. |
Zum Beispiel werden an Kinder verkaufte Ballons mit Heliumgas gefüllt. Im Laufe der Zeit gelangt dieses Gas schließlich durch die Gummiporen des Ballons, dh es kommt zu seinem Erguss. Dies zeigt sich daran, dass sich der Ballon nach einigen Stunden entleert.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Der schottische Chemiker Thomas Graham untersuchte 1829 dieses Verhalten von Gasen. Er kam zu dem Schluss, dass die Geschwindigkeit, mit der ein Gas in einem anderen diffundiert oder ausströmt, mit seiner Dichte zusammenhängt. Als sich seine experimentellen Daten für alle Gase wiederholten, schuf er das folgende Gesetz, das seinen Namen trägt:
Grahams Gesetz: Die Diffusions- oder Effusionsgeschwindigkeit eines Gases ist umgekehrt proportional zur Quadratwurzel seiner Dichte.
Mathematisch kann dieses Gesetz durch die Gleichung ausgedrückt werden:
v α 
Oder bezogen auf zwei verschiedene Gase:
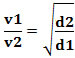
Die hier verwendete Einheit ist das „pro Zeiteinheit entweichende Volumen“; daher generell l/min (Liter pro Minute).
Somit diffundieren Gase mit geringerer Dichte schneller. Befindet es sich im gleichen Temperatur- und Druckzustand, kann man dies auch mit der Masse in Beziehung setzen Gasmolar: Je größer die Dichte des Gases, desto größer seine Molmasse und desto geringer seine Geschwindigkeit von Diffusion; und umgekehrt. Somit haben wir:
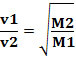
Von Jennifer Fogaça
Abschluss in Chemie
Brasilianisches Schulteam
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Diffusion und Effusion von Gasen"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm. Zugriff am 27. Juli 2021.



