- Neutrales Medium:
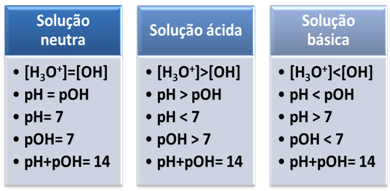
Ein Medium gilt als neutral, wenn es die gleiche Konzentration in mol/L der Hydroniumionen (H3Ö+) und Hydroxid (OH-).
Ein Beispiel für ein neutrales Medium, das sogar als Standard für andere Lösungen dient, ist reines, destilliertes Wasser mit einer Temperatur von 25 °C. Bei dieser Temperatur hat es genau 1. 10-7 mol/L beider Ionen. Daher ist Ihr ionisches Produkt (Kw) ist gleich 10-14 (Mol/L)2:
Kw = [H3Ö+]. [Oh-]
Kw = (1. 10-7 mol/l). (1. 10-7 mol/l) = 10-14 (Mol/L)2
Der pH- und pOH-Wert sind unten angegeben:
pH= - log [H3Ö+] pOH= -log[OH-]
pH = - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Dies zeigt uns, dass in einer neutralen Lösung die pH ist gleich pOH.
- Saures Medium:
In einem sauren Medium ist die Konzentration von H-Ionen3Ö+ ist größer als die von OH-Ionen-.
Eine solche Lösung kann durch Zugabe eines kleinen Teils der H-Ionen erreicht werden3Ö+B. mittels einer Säure.
Nach dem Prinzip von Le Chatelier neigt es dazu, sich selbst neu einzustellen, wenn eine Störung in einem System im Gleichgewicht auftritt, um die Auswirkungen dieser Kraft zu verringern. Das bedeutet, dass bei Zugabe einer Säure zu Wasser die H-Ionen
3Ö+ sie werden im Übermaß sein und das Gleichgewicht verschiebt sich in die umgekehrte Richtung nach links. Diese überschüssigen Ionen reagieren also mit den OH-Ionen-. Somit ist die Konzentration der OH-Ionen- nimmt ab und die Lösung wird sauer.Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)

Das ionische Produkt (Kw) ist immer gleich 10-14, aber die Konzentration der H-Ionen3Ö+ ist größer als die Konzentration der OH-Ionen-1. Daher ist der pH-Wert in einem sauren Medium höher als der pH-Wert, aber seine Summe beträgt immer 14.
Je höher die Konzentration der H-Ionen3Ö+, desto höher der pH-Wert. Bei Raumtemperatur (25 °C), pH < 7 und pOH > 7.

- Basis bedeutet:
Im basischen Medium ist die Konzentration an OH-Ionen- ist größer als die von H-Ionen3Ö+.
Wenn wir Wasser eine Base hinzufügen, bedeutet dies, dass wir OH-Ionen hinzufügen.- und, wie im vorherigen Punkt erklärt, durch das Prinzip von Le Chatelier, das Gleichgewicht der Reaktion von Die Selbstionisierung von Wasser bewegt sich in die entgegengesetzte Richtung, wobei überschüssige Ionen mit H-Ionen3Ö+, verringert Ihre Konzentration und macht die Lösung basisch.
In diesem Fall ist der pH-Wert größer als der pH-Wert. Bei Raumtemperatur (25°C), pH > 7 und pOH < 7.

Knapp:
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Neutrale, saure und basische Medien"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/meios-neutro-acido-basico.htm. Zugriff am 27. Juli 2021.