Bei Verbrennungsreaktionen sie sind in vielen Aspekten unseres täglichen Lebens präsent. Beispielsweise resultieren die Hauptquellen der Energiegewinnung aus der Verbrennung oder Verbrennung bestimmter Brennstoffe, wie unter anderem Ethanol, Benzin, Holzkohle. Darüber hinaus ist die Energie, die wir zum Überleben und zur Arbeit benötigen, das Ergebnis von Verbrennungsreaktionen, die in unseren Zellen stattfinden, wenn wir die Nahrung, die wir essen, „verbrennen“.
Aber was braucht es für eine Verbrennungsreaktion?
Drei Dinge werden benötigt:
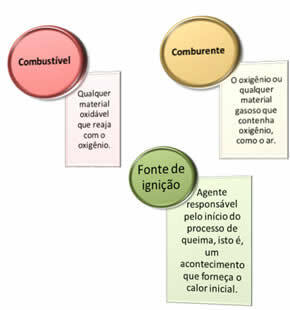
Diese drei Faktoren machen die Feuerdreieck, denn sobald die Verbrennungsreaktion beginnt, hält die freigesetzte Energie die Reaktion aufrecht und lässt sie weiterlaufen, bis der Brennstoff, das Oxidationsmittel oder die Wärme (freigesetzte Energie) verschwunden ist. Dies bedeutet, dass es eine Kettenreaktion.
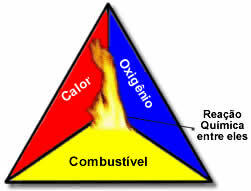
Wenn beispielsweise jemand eine brennende Zigarette in einen Wald wirft, entsteht ein Feuer (Verbrennungsreaktion). In diesem Fall ist die Busch es ist das
Kraftstoff, Ö Sauerstoff in der Luft atmosphärisch ist das Oxidationsmittel es ist das Zigarette angezündet war das Zündquelle. Dieses Brennen wird fortgesetzt, bis einer der drei Faktoren beseitigt ist. Wenn Feuerwehrleute Wasser werfen, wird die Hitze abgeführt. Aber selbst wenn nichts unternommen wird, um dieses Verbrennen zu stoppen, wird es irgendwann aufhören, das heißt, wenn der Brennstoff (Wald) aufgebraucht ist.Wie bereits erwähnt, wird bei diesen Reaktionen Wärme freigesetzt, die Verbrennung ist also eine exotherme Reaktion. Bei dieser Reaktionsart handelt es sich jedoch um eine unvollständige Verbrennung. Um zu verstehen, warum, sehen Sie den Unterschied zwischen vollständiger und unvollständiger Verbrennung:
Vollständige Verbrennung:
Bei der Analyse organischer Verbindungen als Kraftstoffe müssen wir:
| DAS vollständige Verbrennung es tritt auf, wenn die Kohlenstoffkette gebrochen ist und alle Kohlenstoffatome in der Kohlenstoffkette vollständig oxidiert sind. |
| Du geformte Produkte durch Kohlenwasserstoffe werden die CO2 (Kohlendioxid) und h2Ö (Wasser). |
Beobachten Sie die vollständige Verbrennung von Isooctan, das einer der Bestandteile von Benzin ist.
C8h18(g) +25/2 O2 (g) → 8 CO2(g) + 9 Stunden2Ö(1)
unvollständige Verbrennung
| In diesem Fall ist nicht genug Oxidationsmittel vorhanden, dh genug Sauerstoff, um den gesamten Brennstoff zu verbrennen. |
| Die gebildeten Produkte sind also CO (Kohlenmonoxid) und h2Ö. |
Beobachten Sie die gleiche Verbrennung von Isooctan, jetzt jedoch unvollständig:
C8h18(g) + 17/2 O2(g) → 8 CO (g) + 9 Stunden2Ö(1)
Das Abbrennen von Wäldern ist ein Beispiel, da die dabei entstehenden Emissionen aus CO und besonderen Stoffen wie Ruß (C) sowie Asche und anderen einfachen und komplexen organischen Verbindungen bestehen. Stickoxide, Ozon und Aldehyde können auch durch Nebenreaktionen durch die Anwesenheit anderer Bestandteile in der Luft entstehen.
C8h18(g) + 9/2 O2 (g) → 8C (g) + 9 Stunden2Ö(1)
Von Jennifer Fogaça
Abschluss in Chemie
Brasilianisches Schulteam
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm


