DAS Pastaatomar, Wie der Name schon sagt, ist es die Masse eines Atoms, normalerweise symbolisiert durch „mDie“ oder „MA“. Da das Atom jedoch ein extrem kleines, für das menschliche Auge unsichtbares Gebilde ist, ist es beispielsweise nicht möglich, seine Masse mit einer Waage zu messen. Wissenschaftler bestimmten die Masse der Atome, indem sie sie mit den Massen anderer Atome verglichen.
Dies geschieht auch mit den anderen Einheiten. Die Masseneinheit ist beispielsweise das Standard-Kilogramm, was einem Zylinder von 3,917 cm Höhe und Durchmesser aus 10 % Iridium und 90 % Platin entspricht. Es dient also als Vergleich. Wenn wir zum Beispiel ein Objekt auf einer Waage „wiegen“ und wir feststellen, dass seine Masse 10 kg beträgt, bedeutet dies, dass seine Masse 10 Mal größer ist als der gewählte Standard: 1 kg.
Das gleiche gilt für Atome. Als Standard wurde Kohlenstoff-12 gewählt, und diesem Atom wurde willkürlich eine Masse von 12 u zugewiesen. Das „u“ ist die Einheit der Atommasse und entspricht somit 1/12 der Masse eines Kohlenstoffatoms.
Wenn wir zum Beispiel sagen, dass die Atommasse von Wasserstoff gleich 1 u ist, bedeutet dies, dass es so ist, als ob Wenn wir den Kohlenstoff in 12 Teile teilen, entspricht die Masse eines dieser Teile der Masse des Atoms von Wasserstoff. Ein weiteres Beispiel ist Schwefel, seine Atommasse beträgt 32 u, was bedeutet, dass seine Masse 32 mal größer ist als 1/12 der Masse von 12C.
1 u = 1/12 der Masse von 1 Kohlenstoffatom 12

Die atomare Masseneinheit ist 1/12 der Masse von Kohlenstoff-12
Die Molekülmasse von Stoffen ist die Summe der Atommassen der Elemente. Zum Beispiel ist die Atommasse von Sauerstoff gleich 16 u, also die Molekülmasse des Sauerstoffgasmoleküls (O2) ist gleich 32u.
Da Labortechniken derzeit sehr fortgeschritten sind, gibt es Geräte, die die atomare Masse von Elementen genau messen, wie zum Beispiel das Massenspektrometer. Somit ist es möglich zu wissen, dass 1 u ist gleich 1.66054. 10-24 g.
Mindmap: Atommasse

*Um die Mindmap als PDF herunterzuladen, Klicke hier!
Da Atommassen sehr genau bestimmt werden, werden sie im Periodensystem in Form von Dezimalzahlen angegeben. Aber wenn wir die Berechnungen durchführen, verwenden wir normalerweise die gerundete Zahl, mit Ausnahme von Experimenten, die sehr genau sein müssen. Wenn Sie sich beispielsweise das Periodensystem ansehen, werden Sie feststellen, dass die Atommasse von Sauerstoff 15.999 u beträgt, aber wir verwenden in der Regel den Wert 16 u in den Berechnungen. Dies geschieht auch mit Kohlenstoff, dessen Atommasse durch 12.01 u gegeben ist, wie unten gezeigt:
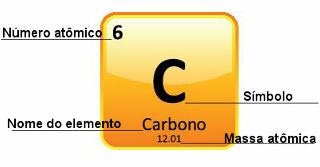
Darstellung von Kohlenstoff im Periodensystem
Die Elemente, die im Periodensystem erscheinen, sind tatsächlich der gewichtete Durchschnitt aller natürlichen Isotope des Elements. Somit ist die in der Tabelle erscheinende Atommasse auch der Durchschnitt der Atommassen dieser Elemente. Chlor (C?) hat beispielsweise zwei natürliche Isotope, 35 und 37, deren jeweiliger Anteil in der Natur 75,76 % und 24,24 % beträgt. Die Atommassen jedes dieser Isotope sind unterschiedlich, wobei die von C&bgr;-35 34,96885 u und die von C&bgr;-37 36,96590 beträgt.
Auf diese Weise wird die Atommasse des Elements unter Berücksichtigung der Masse jedes Isotops und der Häufigkeit, mit der es in der Natur vorkommt, berechnet. Bei Chlor haben wir:
Atommasse des Elements Chlor = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atommasse des Elements Chlor = 35,45
Dies ist der Atommassenwert von Chlor, der im Periodensystem erscheint.
* Mindmap von mir. Diogo Lopes
Von Jennifer Fogaça
Abschluss in Briefen
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
