Oxidation ist die Bezeichnung für den Prozess des Elektronenverlustes durch ein Atom, eine Gruppe oder eine ionische Spezies während eines chemische Reaktion. Es wird an der Zunahme von NOX (Oxidationszahl) der Spezies oder des Atoms beim Vergleich von Reaktant und Produkt.
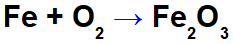
Eisenoxidationsgleichung.
In der obigen Gleichung können wir beispielsweise die NOX jedes Teilnehmers angeben:
Reagenz Eisen (Fe): hat NOX 0, da es a. ist einfache Substanz;
Sauerstoff im Reagenz (O): hat NOX 0, da es eine einfache Substanz ist;
Sauerstoff im Produkt: es enthält NOX -2, da es nicht an ein Alkalimetall gebunden ist, Erdalkali oder Wasserstoff bildend Peroxide oder Superoxide;
Eisen im Produkt: Es hat NOX +3, da die Summe aus NOX von Eisen multipliziert mit 2 (Anzahl der Atome) + NOX von Sauerstoff multipliziert mit 3 0 ergeben muss, da es sich um eine zusammengesetzte Substanz handelt:
x.2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Beim Vergleich von NOX des Reagens Eisen (0) mit dem Produkt (+3) beobachteten wir einen Anstieg, d. h. es durchlief den Prozess von
Oxidation. Es ist erwähnenswert, dass das Auftreten von Oxidation es geht immer mit dem Phänomen der Reduktion (also der Elektronenzunahme) einher, erkennbar an der NOx-Abnahme, wie sie im Beispiel bei Sauerstoff auftritt.Lesen Sie auch:Bestimmung der Oxidationszahl (NOX)
Beispiele für Situationen, in denen Oxidation auftritt:
1. Verbrennung

Auch die Verbrennung eines Materials ist ein Hinweis auf Oxidation.
Verbrennung ist jede chemische Reaktion, die in Gegenwart von a. abläuft Kraftstoff und das oxidierende Sauerstoffgas (O2), was zur Erzeugung von Wärme und Licht führt. Bei jeder Verbrennungsreaktion kommt es vor Oxidation.
2. Einige organische Reaktionen
Bei jeder organischen Reaktion, die in Gegenwart der unten aufgeführten Mittel abläuft, ist der Prozess der Oxidation:
Kaliumdichromat (K2Cr2Ö7) oder Kaliumpermanganat (KMnO4);
Anwesenheit von starker Säure oder starker Base;
Ozongas (O3) in Gegenwart von metallischem Zink (Zn) und Wasser (H2Ö).
3. Batterien oder Batterien

Batterien sind Geräte, bei denen immer Oxidation auftritt.
Stapel oder Batterien sind elektrochemische Geräte, die chemische Stoffe speichern. Einer dieser Stoffe wird oxidiert und der andere wird reduziert, was zur Erzeugung von elektrischem Strom führt.
4. Elektrolyse
Elektrolyse ist ein chemischer Prozess, bei dem eine wässrige Lösung, die ein Salz enthält, einem elektrischen Strom ausgesetzt wird, der schließlich die Oxidation von in diesen Materialien vorhandenen Anionen fördert. Bei jeder Elektrolyse gibt es Oxidation.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm

