Organische Chemie ist ein weites Gebiet der Chemie, das Kohlenstoffverbindungen untersucht.
Das Wissen der Organischen Chemie wird auf verschiedene Weise angegangen und in diesem Sinne haben wir vorgeschlagene Übungen, Aufnahmeprüfungen und Enem-Fragen für Sie zusammengestellt, um Ihr Wissen zu testen.
Nutzen Sie auch die Auflösungskommentare, um noch mehr über das Thema zu erfahren.
Vorgeschlagene Übungen
Frage 1
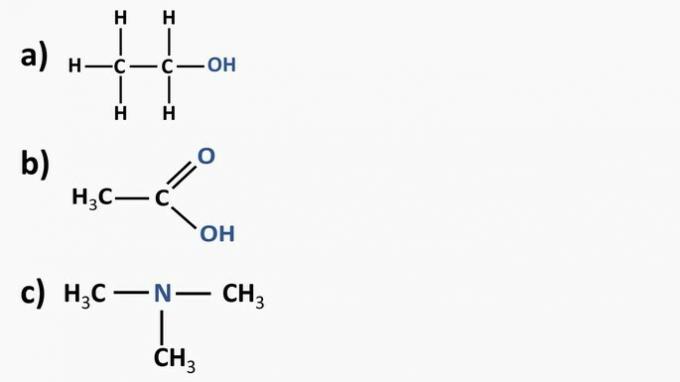
Betrachten Sie die folgenden organischen Verbindungen und identifizieren Sie die organischen Funktionen anhand der hervorgehobenen funktionellen Gruppen. Benennen Sie danach die Stoffe.
Antworten:
a) Organische Verbindung: Ethanol
- organische Funktion: Alkohol
- Allgemeine Formel: R-OH
- Identifikation: Hydroxyl (OH) verbunden mit der Kohlenstoffkette
b) Organische Verbindung: Essigsäure.
- Organische Funktion: Carbonsäure
- Allgemeine Formel: R-COOH
- Identifizierung: Carboxylradikal (COOH), das an die Kohlenstoffkette gebunden ist
c) Organische Verbindung: Trimethylamin
- Organische Funktion: Amin (tertiär)
- Allgemeine Formel:
- Identifikation: Stickstoff an drei Kohlenstoffketten gebunden
Frage 2
In der organischen Chemie erkennt man Verbindungen an den Ketten aus Kohlenstoff und Wasserstoff. Andere Elemente können jedoch Teil der chemischen Struktur dieser Verbindungen sein, wie beispielsweise Sauerstoff.
Wählen Sie die Alternative, bei der die beiden organischen Verbindungen mit Sauerstoff angereicherte organische Funktionen haben.
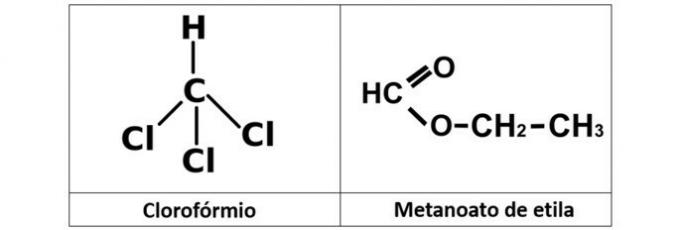
a) Chloroform und Ethylmethanat
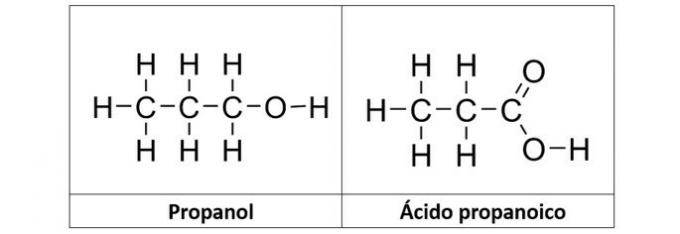
b) Propanol und Propansäure
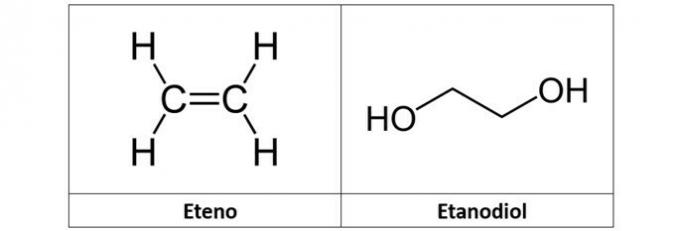
c) Ethen und Ethandiol
d) Ethanamid und Benzol
Richtige Antwort: b) Propanol und Propansäure
eine falsche. Wir haben Chloroform (CHCl3), das ein Alkylhalogenid ist, und der Ethylmethanoatester (C3H6Ö2), das in seiner Struktur Sauerstoff enthält.
b) RICHTIG. In dieser Alternative haben wir zwei Verbindungen mit sauerstoffangereicherten organischen Funktionen. Das Propanol (C3H8O) ist ein aus drei Kohlenstoffatomen gebildeter Alkohol. Die Propansäure (C3H6Ö2) ist eine Carbonsäure.
c) FALSCH. Das Ethylen (C2H4), auch Ethylen genannt, ist ein Kohlenwasserstoff vom Alkentyp. Bereits Ethandiol (C2H6Ö2) ist ein Alkohol mit zwei Hydroxylen in seiner Struktur.
d) FALSCH. Ethanamid (C2H5NO) ist ein Amid und Benzol ist ein aromatischer Kohlenwasserstoff und wird daher nur aus Kohlenstoff und Wasserstoff gebildet.

Frage 3
Schauen Sie sich die Struktur der organischen Verbindung unten an und überprüfen Sie die wahren Aussagen.

(01) Die Verbindung hat eine organische Stickstofffunktion.
(02) Es ist ein primäres Amin, da es nur an einen Wasserstoff gebunden ist.
(03) Der Name der Verbindung ist Diethylamin.
Richtige Antwort:
(01) RICHTIG. Die in der Verbindung vorhandene stickstoffhaltige organische Funktion ist Amin.
(02) FALSCH. Es ist ein sekundäres Amin, da Stickstoff an zwei Kohlenstoffketten gebunden ist.
(03) FALSCH. Der Name der Verbindung ist Dimethylamin, da an Stickstoff zwei Methylradikale gebunden sind.
Frage 4
Eugenol, ein Mitglied der Phenylpropanoid-Familie, ist eine aromatische organische Verbindung, die in Gewürznelken vorkommt, einem Gewürz, das seit der Antike verwendet wird.

Beobachten Sie die Strukturformel der Verbindung und identifizieren Sie die vorhandenen organischen Funktionen.
a) Alkohol und Äther
b) Phenol und Ether
c) Alkohol und Ester
d) Phenol und Ester
e) Alkohol und Kohlenwasserstoff
Richtige Alternative: b) Phenol und Ether.
Eugenol hat in seiner Kette sauerstoffangereicherte organische Funktionen, d. h. neben Kohlenstoff- und Wasserstoffatomen ist Sauerstoff ein vorhandenes Heteroatom.
Die organische Phenolfunktion ist durch das Hydroxyl (-OH) gekennzeichnet, das an einen aromatischen Ring gebunden ist. Bei der Etherfunktion befindet sich Sauerstoff zwischen zwei Kohlenstoffketten.
Frage 5
EDTA, dessen vollständiger Name Ethylendiamintetraessigsäure ist, ist eine organische Verbindung mit vielen Anwendungen. Seine Fähigkeit, Metallionen zu binden, macht es zu einem Chelatbildner, der sowohl im Labor als auch in der Industrie weit verbreitet ist.
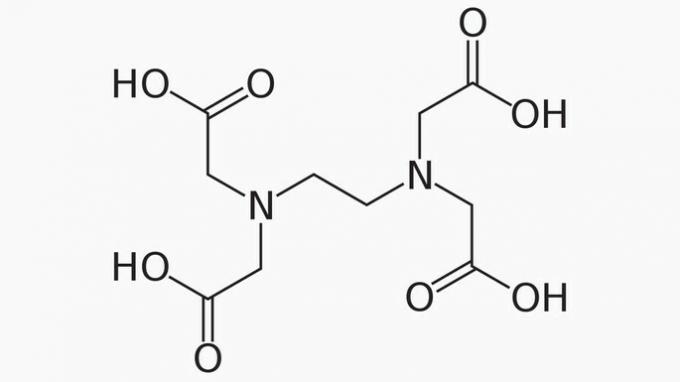
Über EDTA ist es richtig zu sagen, dass die Kohlenstoffkette ist:
a) Offen, homogen und ungesättigt.
b) Geschlossen, heterogen und gesättigt.
c) Offen, heterogen und ungesättigt.
d) Geschlossen, homogen und gesättigt.
e) Offen, heterogen und gesättigt.
Richtige Antwort: e) Offen, heterogen und gesättigt.
Die EDTA-Kette ist unterteilt in:
ÖFFNEN. An der Anordnung der Kohlenstoffatome in der Struktur von EDTA können wir erkennen, dass durch das Vorhandensein von Enden die Kette der Verbindung geöffnet wird.
HETEROGEN. Neben Kohlenstoff- und Wasserstoffverbindungen weist die Kohlenstoffkette Stickstoff- und Sauerstoffheteroatome auf.
GESÄTTIGT. Die Bindungen zwischen den Kohlenstoffatomen sind gesättigt, da die Kette nur Einfachbindungen aufweist.
Erfahren Sie mehr unter: Organische Chemie.
Fragen zur Aufnahmeprüfung
Frage 1
(UFSC) Beobachten Sie die unvollständigen organischen Strukturen und identifizieren Sie die richtigen Elemente:
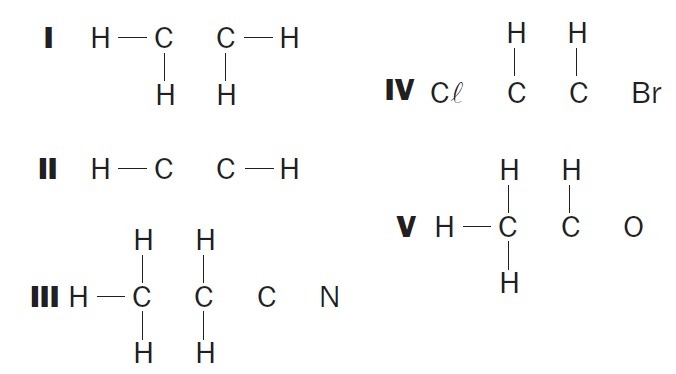
(01) Struktur I fehlt eine Einfachbindung zwischen den Kohlenstoffatomen.
(02) Struktur II fehlt eine Dreifachbindung zwischen den Kohlenstoffatomen.
(03) Struktur III fehlen zwei Einfachbindungen zwischen Kohlenstoffatomen und ein Tripel zwischen Kohlenstoff- und Stickstoffatomen.
(04) Struktur IV fehlen zwei Einfachbindungen zwischen Kohlenstoffatomen und Halogenen und eine Doppelbindung zwischen Kohlenstoffatomen.
(05) Struktur V fehlt eine Einfachbindung zwischen Kohlenstoffatomen und eine Einfachbindung zwischen Kohlenstoff- und Sauerstoffatomen.
Richtige Alternativen: 02, 03 und 04.
Neben Kohlenstoff, einem obligatorischen chemischen Element in organischen Verbindungen, können andere Elemente in Strukturen vorhanden und durch kovalente Bindungen verbunden sein, bei denen Elektronen geteilt werden.
Die Wertigkeit der Elemente bestimmt die Anzahl der Bindungen, die gebildet werden können, wie in der folgenden Tabelle gezeigt.
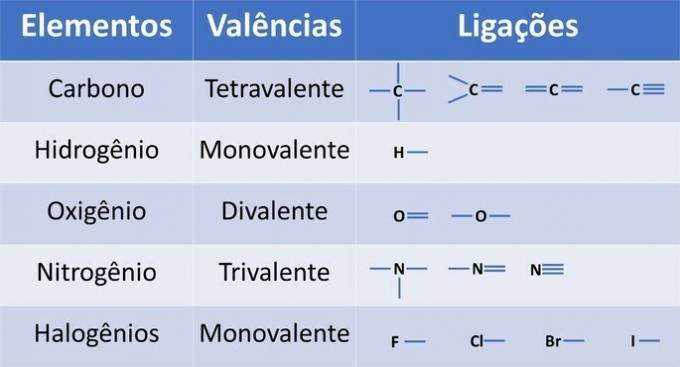
Aus diesen Informationen haben wir:
(01) FALSCH. Der Struktur fehlt eine Doppelbindung zwischen den Kohlenstoffatomen, um die Ethenverbindung zu bilden.
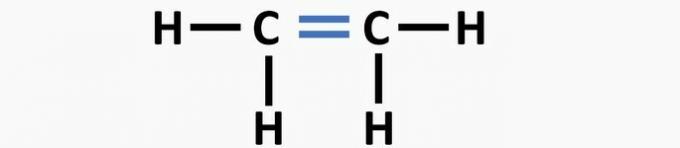
(02) RICHTIG. Der Struktur fehlt eine Dreifachbindung zwischen den Kohlenstoffatomen, um die Ethinverbindung zu bilden.
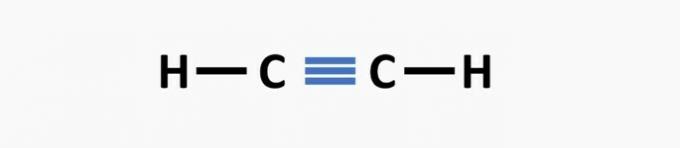
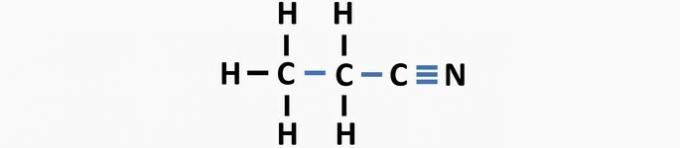
(03) RICHTIG. Der Struktur fehlen Einfachbindungen zwischen Kohlenstoffen und Dreifachbindungen zwischen Kohlenstoff und Stickstoff, um die Verbindung Propannitril zu bilden.
(04) RICHTIG. Der Struktur fehlen Einfachbindungen zwischen Kohlenstoff und Halogen und Doppelbindungen zwischen Kohlenstoffen, um die Dichlorethenverbindung zu bilden.
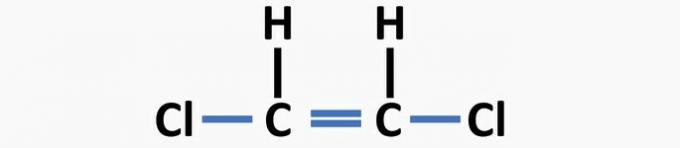
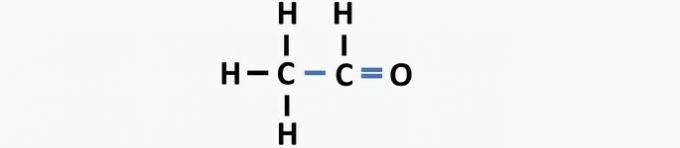
(05) FALSCH. Der Struktur fehlt eine Einfachbindung zwischen Kohlenstoffen und eine Doppelbindung zwischen Kohlenstoff und Sauerstoff, um die Ethanalverbindung zu bilden.
Frage 2
(UFPB) Die Struktur der organischen Verbindung der Summenformel C5H8Was eine verzweigte, ungesättigte, heterogene und alicyclische Kette darstellt, ist:

Richtige Alternative: d.
Kohlenstoffketten können wie folgt klassifiziert werden:
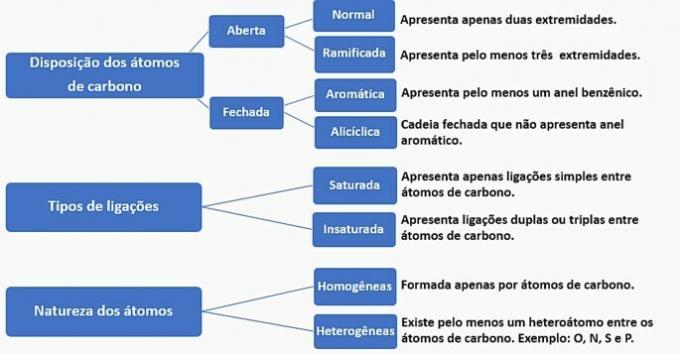
Nach diesen Informationen haben wir:
eine falsche. Die Kette wird als normal, gesättigt, homogen und alizyklisch klassifiziert.
b) FALSCH. Die Kette wird als normal, ungesättigt, homogen und offen klassifiziert.
c) FALSCH. Die Kette wird als verzweigt, ungesättigt, homogen und offen klassifiziert.
d) RICHTIG. Die Kette wird als verzweigt, ungesättigt, heterogen und alicyclisch klassifiziert, als
- Es hat eine Verzweigung: Methylrest;
- Hat Ungesättigtheit: Doppelbindung zwischen Kohlenstoffen;
- Es hat ein Heteroatom: Sauerstoff, der an zwei Kohlenstoffe gebunden ist;
- Es stellt eine geschlossene Kette dar: Kohlenstoffe, die in einem Kreis verbunden sind, ohne dass ein aromatischer Ring vorhanden ist.
e) FALSCH. Die Kette wird als verzweigt, ungesättigt, heterogen und offen klassifiziert.
Frage 3
(Centec-BA) In der unten gezeigten Struktur sind die nummerierten Kohlenstoffe jeweils:
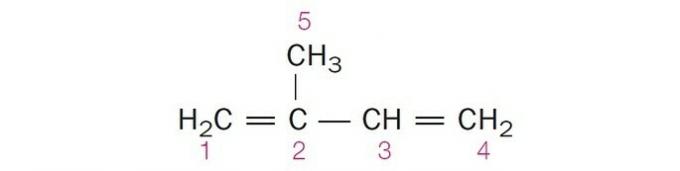
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Richtige Alternative: c) sp2, sp2, sp2, sp2, sp3.
Aufgrund seiner 4 Elektronen in der Valenzschale ist Kohlenstoff vierwertig, d. h. er neigt dazu, 4 kovalente Bindungen zu bilden. Diese Bindungen können einfach, doppelt oder dreifach sein.
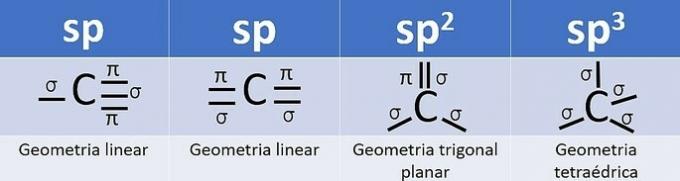
Die Zahl der Hybridorbitale ist die Summe der Sigma-Bindungen (σ) des Kohlenstoffs, da die Bindung hybridisiert nicht.
- sp: 2 Sigma-Links
- sp2: 3 Sigma-Links
- sp3: 4 Sigma-Links
Nach diesen Informationen haben wir:
eine falsche. Kohlenstoff 2 hat sp-Hybridisierung2, da es 3 σ-Bindungen und eine Bindung hat .
b) FALSCH. Kohlenstoff hat keine sp-Hybridisierung4 und sp-Hybridisierung tritt auf, wenn eine Dreifachbindung oder zwei Doppelbindungen zwischen Kohlenstoffen vorhanden sind.
c) RICHTIG. Die Summe der σ-Bindungen an jedem Kohlenstoff ergibt die alternative Hybridisierung.
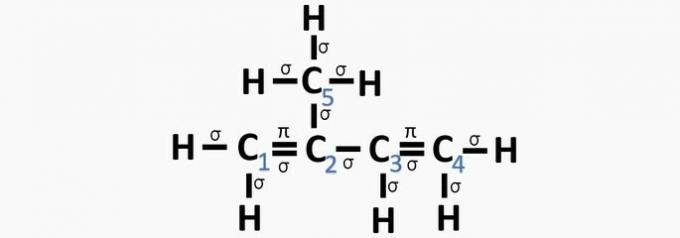
d) FALSCH. Sp-Hybridisierung tritt auf, wenn zwischen den Kohlenstoffen eine Dreifachbindung oder zwei Doppelbindungen vorhanden sind.
e) FALSCH. Kohlenstoff hat keine sp-Hybridisierung4 und sp-Hybridisierung tritt auf, wenn eine Dreifachbindung oder zwei Doppelbindungen zwischen den Kohlenstoffen vorhanden sind.
Frage 4
(UFF) Es gibt eine gasförmige Probe, die von einer der folgenden Verbindungen gebildet wird: CH4; Ç2H4; Ç2H6; Ç3H6 oder C3H8. Wenn 22 g dieser Probe bei einem Druck von 0,5 atm und einer Temperatur von 27 °C ein Volumen von 24,6 l einnehmen (Angabe: R = 0,082 l .atm. K–1.mol–1), wird geschlossen, dass es sich um das Gas handelt:
a) Ethan.
b) Methan.
c) Propan.
d) Propylen.
e) Ethen.
Richtige Alternative: c) Propan.
1. Schritt: Umrechnen der Temperatureinheit von Celsius in Kelvin.
2. Schritt: Berechnen Sie die Molzahl der Verbindung mit der allgemeinen Gasgleichung.
3. Schritt: Berechnen Sie die Molmasse der Verbindung.
4. Schritt: Finden Sie den Kohlenwasserstoff mit einer Molmasse von 44 g/mol.
Methan
Ethen
Ethan
Propylen
Propan
Daraus wird geschlossen, dass es sich bei dem Gas, das den Angaben in der Erklärung entspricht, um Propan handelt.
Frage 5
(ITA) Betrachten Sie die folgenden Stoffe:
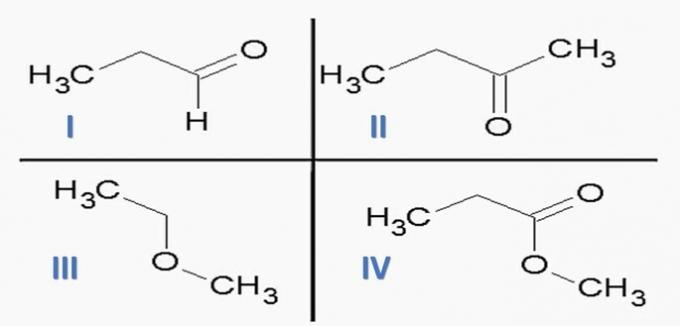
und die folgenden chemischen Funktionen:
Das. Carbonsäure;
B. Alkohol;
ç. Aldehyd;
d. Keton;
und. Ester;
f. Äther.
Die Option, die Stoffe KORREKT mit chemischen Funktionen zuordnet, ist:
a) ID; IIc; IIIe; IVf.
b) Ic; IId; IIIe; MwSt.
c) Ic; IId; IIIf; Ich habe.
d) Identifikation; IIc; IIIf; Ich habe.
e) Ia; IIc; IIIe; IVd.
Richtige Alternative: c) Ic; IId; IIIf; Ich habe.
Organische Funktionen werden durch Strukturen bestimmt und gruppieren organische Verbindungen mit ähnlichen Eigenschaften.
Die in den Alternativen vorhandenen chemischen Funktionen sind:
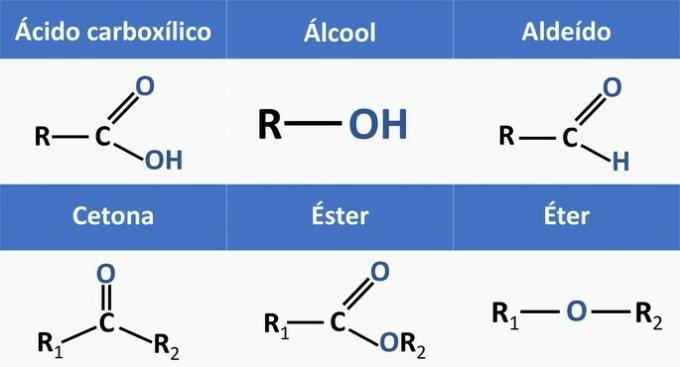
Wenn wir die obigen Strukturen und die in der Aussage enthaltenen Verbindungen analysieren, erhalten wir:
eine falsche. Die Organfunktionen sind korrekt, aber die Reihenfolge ist falsch.
b) FALSCH. Unter den Verbindungen gibt es keine Carbonsäure.
c) RICHTIG. In den Verbindungen vorhandene funktionelle Gruppen repräsentieren die folgenden chemischen Funktionen.

d) FALSCH. I ist Aldehyd und II ist Keton.
e) FALSCH. Unter den Verbindungen gibt es keine Carbonsäure.
Erfahren Sie mehr unter: Organische Funktionen.
Enem-Fragen
Frage 1
(Enem/2014) Eine Methode zur Bestimmung des Ethanolgehalts in Benzin besteht darin, bekannte Mengen Wasser und Benzin in einer bestimmten Flasche zu mischen. Nach Schütteln des Kolbens und Warten werden die Volumina der beiden erhaltenen nicht mischbaren Phasen gemessen: eine organische und die andere wässrig. Ethanol, das früher mit Benzin mischbar war, ist jetzt mit Wasser mischbar.
Um das Verhalten von Ethanol vor und nach der Zugabe von Wasser zu erklären, ist es notwendig zu wissen
a) die Dichte von Flüssigkeiten.
b) die Größe der Moleküle.
c) der Siedepunkt von Flüssigkeiten.
d) die in den Molekülen vorhandenen Atome.
e) die Art der Wechselwirkung zwischen den Molekülen.
Richtige Alternative: e) die Art der Wechselwirkung zwischen den Molekülen.
Intermolekulare Kräfte beeinflussen die Löslichkeit organischer Verbindungen. Stoffe neigen dazu, sich ineinander aufzulösen, wenn sie die gleiche zwischenmolekulare Kraft haben.
In der folgenden Tabelle finden Sie einige Beispiele für organische Funktionen und die Art der Wechselwirkung zwischen Molekülen.
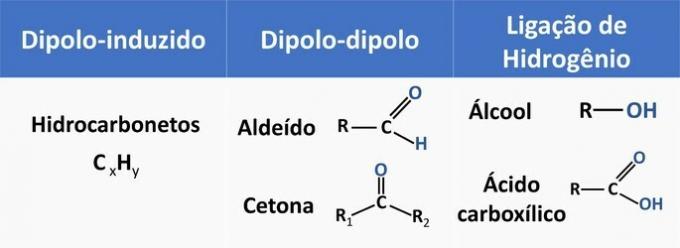
Ethanol gilt als polares Lösungsmittel, da es eine polare Gruppe (-OH) in seiner Struktur hat. Jedoch ist seine Kohlenstoffkette, die unpolar ist (CH), in der Lage, mit unpolaren Lösungsmitteln zu interagieren. Daher löst sich Ethanol sowohl in Wasser als auch in Benzin auf.
Nach diesen Informationen haben wir:
eine falsche. Die Dichte bezieht die Masse eines Körpers auf das eingenommene Volumen.
b) FALSCH. Die Größe der Moleküle beeinflusst die Polarität der Verbindungen: Je größer die Kohlenstoffkette, desto unpolarer wird die Substanz.
c) FALSCH. Der Siedepunkt ist nützlich, um Moleküle zu trennen: Destillation trennt Verbindungen mit unterschiedlichen Siedepunkten. Je niedriger der Siedepunkt, desto leichter wird das Molekül verdampft.
d) FALSCH. Ein Aldehyd hat Kohlenstoff, Wasserstoff und Sauerstoff in seiner Struktur. Diese Verbindung führt Dipol-Dipol-Wechselwirkungen aus, während ein Alkohol mit den gleichen Elementen in der Lage ist, Wasserstoffbrückenbindungen zu bilden.
e) RICHTIG. Die Wechselwirkung von Ethanol mit Wasser (Wasserstoffbrückenbindung) ist intensiver als mit Benzin (diploinduziert).
Frage 2
(Enem/2013) Die Moleküle von Nanoputianer sie ähneln menschlichen Figuren und wurden geschaffen, um das Interesse junger Menschen am Verständnis der Sprache zu wecken, die in Strukturformeln ausgedrückt wird, die in der organischen Chemie weit verbreitet sind. Ein Beispiel ist NanoKid, dargestellt in der Abbildung:
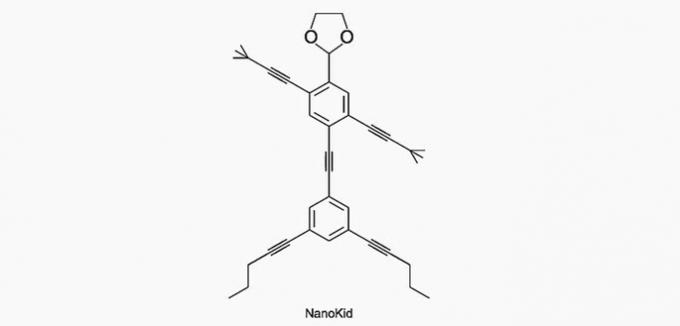
Wo im Körper des NanoKid befindet sich quartärer Kohlenstoff?
a) Hände.
b) Kopf.
c) Brust.
d) Bauch.
e) Füße.
Richtige Alternative: a) Hände.
Kohlenstoff wird wie folgt klassifiziert:
- Primär: bindet an einen Kohlenstoff;
- Sekundär: bindet an zwei Kohlenstoffe;
- Tertiär: bindet an drei Kohlenstoffe;
- Quartär: bindet an vier Kohlenstoffe.
Siehe die Beispiele unten.

Nach diesen Informationen haben wir:
a) RICHTIG. Der Kohlenstoff in der Hand ist mit vier anderen Kohlenstoffen verbunden, also quartär.
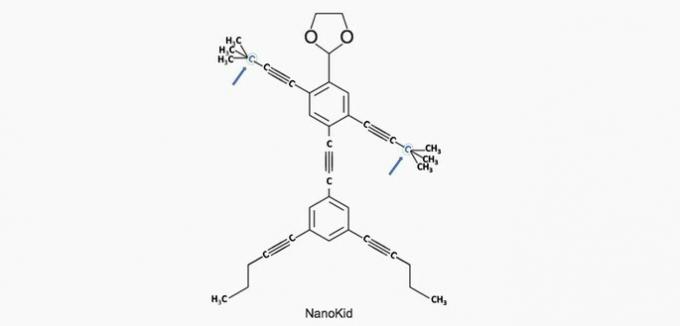
b) FALSCH. Der Kopf besteht aus Primärkohlenstoff.
c) FALSCH. Die Brust besteht aus sekundären und tertiären Kohlenstoffen.
d) FALSCH. Der Bauch besteht aus sekundären Kohlenstoffen.
e) FALSCH. Die Füße bestehen aus Primärkohlenstoff.
Frage 3
(Enem/2014) Einige Polymermaterialien können nicht für die Herstellung bestimmter Arten von Artefakten verwendet werden, weder für Einschränkungen der mechanischen Eigenschaften, entweder durch die Leichtigkeit, mit der sie abgebaut werden, wodurch unerwünschte Nebenprodukte erzeugt werden Anwendung. Daher wird eine Inspektion wichtig, um die Natur des Polymers zu bestimmen, das bei der Herstellung des Artefakts verwendet wird. Eine der möglichen Methoden basiert auf der Zersetzung des Polymers, um die Monomere zu erzeugen, aus denen es entstanden ist.
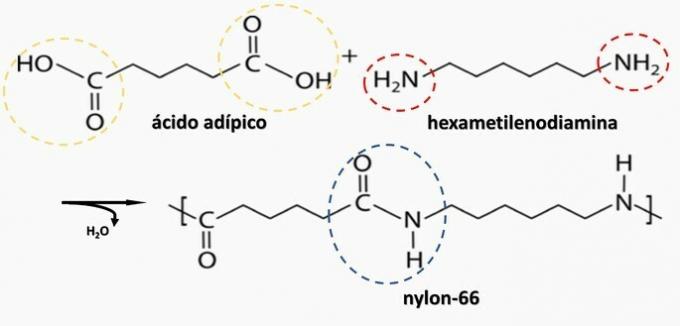
Kontrollierte Zersetzung eines artefakterzeugten Diamins H2N(CH2)6NH2 und die HO-Disäure2C(CH2)4CO2H. Daher wurde das Artefakt aus
a) Polyester.
b) Polyamid.
c) Polyethylen.
d) Polyacrylat.
e) Polypropylen.
Richtige Alternative: b) Polyamid.
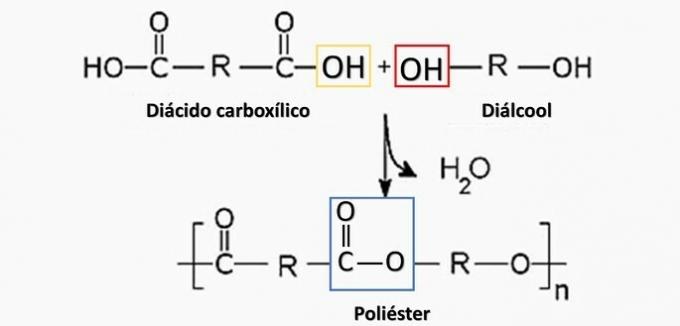
eine falsche. Polyester entsteht bei der Reaktion zwischen einer Dicarbonsäure (-COOH) und einem Dialkohol (-OH).
b) RICHTIG. Polyamid entsteht durch die Polymerisation einer Dicarbonsäure (-COOH) mit einem Diamin (-NH2).
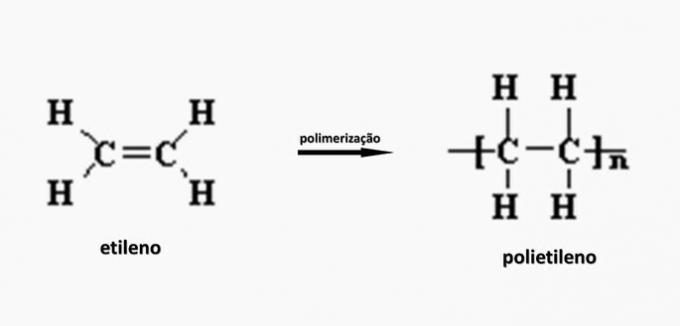
c) FALSCH. Polyethylen wird bei der Polymerisation von Ethylenmonomer gebildet.
d) FALSCH. Polyacrylat wird durch ein von Carbonsäure abgeleitetes Salz gebildet.
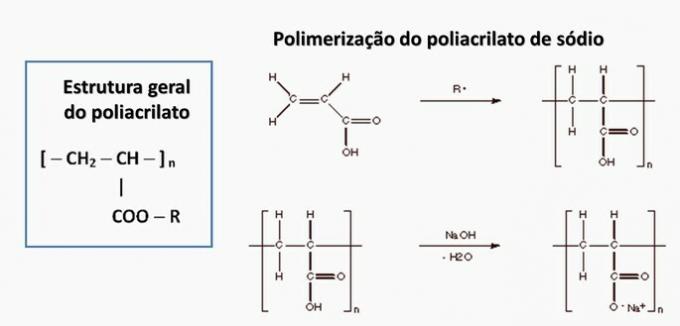
e) FALSCH. Polypropylen wird bei der Polymerisation von Propylenmonomer gebildet.
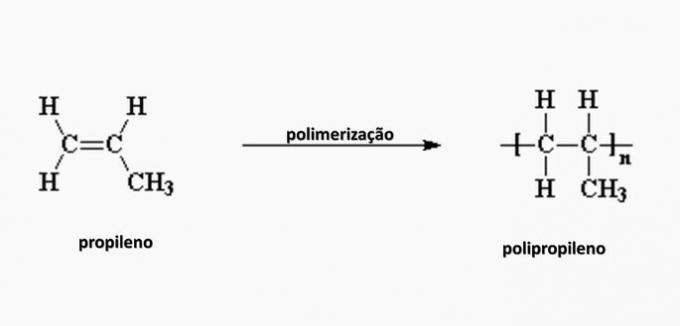
Frage 4
(Enem/2008) China hat sich verpflichtet, Russland für den Austritt von Benzol aus einer Industrie zu entschädigen Chinesische Petrochemie im Songhua-Fluss, einem Nebenfluss des Amur-Flusses, der einen Teil der Grenze zwischen den beiden bildet Länder. Der Präsident der Föderalen Wasserressourcenbehörde Russlands versicherte, dass das Benzol nicht in die Pipelines von Trinkwasser, forderte aber die Bevölkerung auf, fließendes Wasser abzukochen und das Fischen im Amur und seinen Nebenflüsse. Die lokalen Behörden lagern Hunderte Tonnen Kohle, da das Mineral als wirksamer Benzolabsorber gilt. Internet: (mit Anpassungen). Unter Berücksichtigung der getroffenen Maßnahmen zur Minimierung von Umwelt- und Bevölkerungsschäden ist es richtig, dass
a) Kohle reagiert in Wasser mit Benzol und eliminiert es.
b) Benzol ist flüchtiger als Wasser und muss daher gekocht werden.
c) die Ausrichtung auf die Vermeidung von Fischfang beruht auf der Notwendigkeit, Fische zu erhalten.
d) Benzol würde Trinkwasserleitungen nicht verunreinigen, da es auf natürliche Weise am Grund des Flusses dekantiert würde.
e) die Verschmutzung durch den Benzolaustritt der chinesischen Industrie würde sich auf den Songhua-Fluss beschränken.
Richtige Alternative: b) Benzol ist flüchtiger als Wasser und muss daher abgekocht werden.
eine falsche. Kohle enthält in ihrer Struktur mehrere Poren und wird als Adsorptionsmittel verwendet, da sie in der Lage ist, mit Verunreinigungen zu interagieren und diese an ihrer Oberfläche zurückzuhalten, aber nicht zu beseitigen.
b) RICHTIG. Je höher die Flüchtigkeit eines Stoffes ist, desto leichter geht er in einen gasförmigen Zustand über. Während der Siedepunkt von Wasser 100 °C beträgt, beträgt der von Benzol 80,1 °C. Dies liegt daran, dass Wasser eine polare Verbindung und Benzol eine unpolare Verbindung ist.
Die Art der Wechselwirkungen, die Moleküle eingehen, sind unterschiedlich und beeinflussen auch den Siedepunkt von Substanzen. Das Wassermolekül kann Wasserstoffbrückenbindungen eingehen, eine Art von Wechselwirkung, die viel stärker ist als die, die Benzol mit dem induzierten Dipol eingehen kann.
c) FALSCH. In einer Nahrungskette wird ein Wesen gemäß den Interaktionen der Arten an einem Ort zur Nahrung eines anderen. Wenn ein giftiger Stoff in die Umwelt freigesetzt wird, kommt es zu einer fortschreitenden Akkumulation und Fisch kontaminiert, wenn sie vom Menschen aufgenommen werden, können Benzol mitnehmen und DNA-Mutationen verursachen und sogar sogar Krebs.
d) FALSCH. Benzol hat eine geringere Dichte als Wasser. Der Trend geht also dahin, dass es sich auch unter Wasser weiter ausbreitet.
e) FALSCH. Saisonale Veränderungen können das Problem noch verstärken, da niedrige Temperaturen die biologische Abbaufähigkeit von Chemikalien durch die Einwirkung von Sonne oder Bakterien verringern.
Frage 5
(Enem/2019) Kohlenwasserstoffe sind organische Moleküle mit einer Reihe von industriellen Anwendungen. Sie liegen beispielsweise in großen Mengen in verschiedenen Erdölfraktionen vor und werden üblicherweise aufgrund ihrer Siedetemperatur durch fraktionierte Destillation abgetrennt. Die Tabelle zeigt die Hauptfraktionen, die bei der Destillation von Erdöl in verschiedenen Temperaturbereichen anfallen.
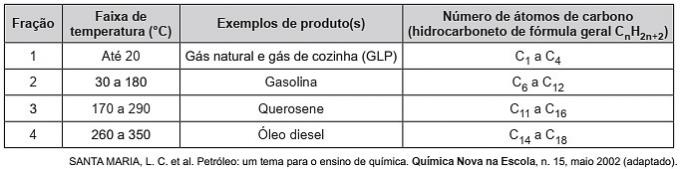
In Fraktion 4 erfolgt die Trennung der Verbindungen bei höheren Temperaturen, weil
a) ihre Dichten sind größer.
b) die Anzahl der Zweige ist größer.
c) seine Löslichkeit in Öl ist größer.
d) intermolekulare Kräfte sind stärker.
e) die Kohlenstoffkette ist schwieriger zu brechen.
Richtige Alternative: d) die intermolekularen Kräfte sind stärker.
Kohlenwasserstoffe interagieren durch induzierten Dipol und diese Art von intermolekularer Kraft wird mit der Zunahme der Kohlenstoffkette verstärkt.
Daher haben die schwereren Erdölfraktionen eine höhere Siedetemperatur, da die Ketten durch einen induzierten Dipol stärker wechselwirken.
Weitere Übungen mit kommentierter Auflösung finden Sie auch unter:
- Übungen zu Kohlenwasserstoffen
- Übungen zu organischen Funktionen
- Chemiefragen in Enem
