Es kann vorkommen, dass es Säuren des gleichen Elements gibt und dieses Element die gleiche Oxidationszahl (NOX) hat, aber der Unterschied liegt im Hydratationsgrad.
Im Folgenden haben wir zum Beispiel drei Säuren, die durch das Element Phosphor (P) gebildet werden:
H3STAUB4 H4P2Ö7 HPO3
Beachten Sie, dass in allen drei Säuren die Oxidationszahl von Phosphor +5 beträgt; der Unterschied liegt im Hydratationsgrad.
Darauf aufbauend werden diese Säuren in der Nomenklatur durch die Vorsilben unterschieden ortho, pyro und meta.
Die am stärksten hydratisierte Säure heißt ortho. Im gegebenen Beispiel ist die erste (H3STAUB4) wird genannt Acid orthoPhosphorsäure, weil es von den dreien am stärksten hydratisiert ist. Das Ortho-Präfix ist entbehrlich, daher wird diese Säure meistens nur genannt Phosphorsäure.
Die Präfixe pyro und meta werden mit Orthosäure als Bezugspunkt verwendet:
- Pyrus: 2 Moleküle ortho minus 1 Molekül H2Ö
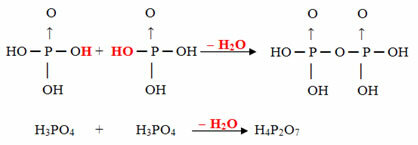
Beispiel: Das H4P2Ö7 wird genannt Acid piroPhosphorsäure weil es gleich zwei Molekülen Orthophosphorsäure (H3STAUB4) minus einem Wassermolekül.
2. H3STAUB4 =H6P2Ö8
H6P2Ö8 - H2O = H4P2Ö7
Dieser Vorgang ist ein intermolekulare Dehydration:
- Ziel: 1 Molekül ortho minus 1 Molekül H2Ö
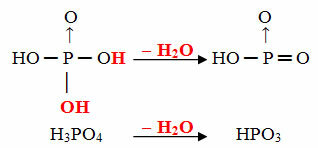
Beispiel: Das HPO3 wird genannt Acid TorPhosphorsäure weil es einem Molekül Orthophosphorsäure (H3STAUB4) minus einem Wassermolekül.
H3STAUB4 - H2O = HPO3
Dieser Vorgang ist ein intramolekulare Dehydration:
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm
